Die chronisch-entzündlichen Darmerkrankungen Colitis ulcerosa (CU) und Morbus Crohn (MC) gehören zu den häufigen Krankheiten. In der Schweiz sind rund 20.000 Menschen davon betroffen.1 Bei der Pathogenese der CEDs spielen mehrere Faktoren eine Rolle, darunter genetische Prädisposition und epigenetische Einflüsse, Störungen des Immunsystems und des Mikrobioms sowie ungünstige externe Umwelteinflüsse, z. B. ungesunde Ernährung.2 Diese führen zu pathologischen Immunreaktionen des Darms, die schliesslich in einer chronischen Entzündung der Mukosa münden. Charakteristische Symptome einer CED sind unter anderem Durchfälle ggf. mit Blut im Stuhl und Bauchschmerzen bei chronischem Verlauf mit akuten Schüben und schubfreien Perioden. Die Diagnostik von CU und MC basiert auf dem klinischen Befund, Labor- und Gewebeuntersuchungen sowie bildgebenden Verfahren (z. B. Endoskopie, Röntgen, Ultraschall, CT).3 Differentialdiagnostisch sind bei der CU die Läsionen auf das Kolon beschränkt und das Rektum ist immer befallen, während beim MC oft auch Läsionen im Dünndarm nachweisbar sind und das Rektum häufig ausgespart ist. Zudem können MC-Patienten Fisteln entwickeln, bei der CU treten hingegen keine Fisteln auf.
Therapeutische Ansätze bei CEDs
Für Patienten mit chronisch entzündlichen Darmerkrankungen gibt es ‒ ausser einer Operation bei Colitis ulcerosa ‒ derzeit keine kurative Behandlungsmöglichkeit.3 Die Therapieziele bestehen daher darin, frühzeitig eine Remission herbeizuführen und diese langfristig aufrechtzuerhalten, um ein Rezidiv zu verhindern.3 In der aktiven Krankheitsphase ist es notwendig, den Allgemeinzustand des Patienten und das Ausmass der Erkrankung exakt zu diagnostizieren und dann eine leitliniengerechte Therapie einzuleiten.3 Hier geht der Trend hin zur personalisierten Präzisionsmedizin, bei der die Behandlung auf die individuellen Bedürfnisse des jeweiligen Patienten abgestimmt wird und molekulare Informationen genutzt werden, um massgeschneiderte Therapien anzubieten.2
Medikamentöse Behandlung
Für die medikamentöse Behandlung einer CED kommen verschiedene Substanzen aus ganz unterschiedlichen Wirkstoffgruppen zum Einsatz. Hierzu gehören unter anderem3–6:
-
Aminosalizylate: Bei der 5-Aminosalicylsäure (5-ASA, Mesalazin) und ihren Derivaten handelt es sich um entzündungshemmende Wirkstoffe, welche die Produktion proinflammatorischer Arachidonsäure-Metabolite, darunter Prostaglandine und Leukotriene, hemmen. Sie werden sowohl zur Behandlung akuter Schübe als auch zum Remissionserhalt eingesetzt. Zur CED-Therapie werden Aminosalizylate oral oder rektal verabreicht. In der Schweiz sind Mesalazin zur Akutbehandlung oder Rezidivprophylaxe der CU und Sulfasalazin zur Therapie von MC und CU zugelassen. Weitere Aminosalizylate sind Olsalazin und Balsalazid.
-
Kortikosteroide: Diese Präparate wirken stark entzündungshemmend, indem sie verschiedene Zelltypen wie Mastzellen, Eosinophile, Neutrophile, Makrophagen und Lymphozyten beeinflussen sowie zahlreiche proinflammatorische Signalmoleküle, z. B. Interleukine, hemmen. Zur Behandlung von chronisch entzündlichen Darmerkrankungen werden Kortikosteroide oral, rektal oder als Infusion bzw. Injektion verabreicht. In der Schweiz sind Präparate mit den Wirkstoffen Budesonid, Prednison, Prednisolon, Methylprednisolon, Betamethason, Dexamethason, Deflazacort und Hydrocortison zur Behandlung von CEDs zugelassen.
-
Immunmodulatoren: In dieser Gruppe werden Substanzen zusammengefasst, die das Immunsystem über verschiedene Wirkmechanismen beeinflussen. So hemmen Azathioprin und 6-Mercaptopurin die Funktion von T-Zellen und können auch deren Apoptose induzieren. Methotrexat hemmt das Enzym Dihydrofolatreduktase und damit die DNA- und RNA-Synthese, was wiederum die Zellproliferation beeinträchtigt. Der Wirkstoff wird niedrig dosiert als Immunsuppressivum und in höherer Dosierung als Zytostatikum eingesetzt. Ciclosporin und Tacrolimus blockieren die Aktivierung von T-Lymphozyten und damit die zelluläre Immunantwort. In der Schweiz sind Azathioprin (Filmtabletten) zur Behandlung von Morbus Crohn und Colitis ulcerosa sowie Methotrexat (Fertigspritze) zur Therapie des Morbus Crohn zugelassen.
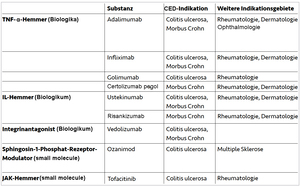
Neben diesen konventionellen Therapien wurden in den letzten Jahren zunehmend Biologika und niedermolekulare Substanzen («small molecules») zur Behandlung von CEDs entwickelt, die an Zytokinen und deren Signalwegen oder an Oberflächenproteinen von Immunzellen angreifen, um so die Entzündungsprozesse gezielt zu stoppen (Tabelle 1).3–8
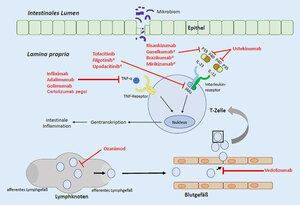
Adalimumab, Infliximab, Golimumab und Certolizumab pegol sind Biologika, die das proinflammatorische Zytokin Tumornekrosefaktor-α (TNF-α) blockieren. Dadurch hemmen sie über verschiedene Mechanismen die Entzündungsprozesse, unter anderem durch die Induktion der Apoptose von T-Zellen in der Lamina propria.9 Einige TNF-α-Hemmer fördern zudem die Wundheilung, indem sie die Aktivität von M2-Makrophagen anregen.9 Ustekinumab, Risankizumab, Guselkumab, Brazikumab und Mirikizumab sind ebenfalls biotechnologisch hergestellte Substanzen, die an Untereinheiten der proinflammatorischen Interleukine IL-23 bzw. IL-12 binden und so gegen Entzündungsreaktionen im Körper wirken.7 Die Biologika Vedolizumab und Natalizumab unterdrücken die Entzündung, indem sie als Integrinantagonisten die Migration von Memory-T-Lymphozyten durch das vaskuläre Endothel in den Darm hemmen. Bei der CED-Therapie kommen auch niedermolekulare Verbindungen («small molecules») zum Einsatz. Hierzu zählt der Januskinase(JAK)-Hemmer Tofacitinib, der die Signalübertragung von verschiedenen proinflammatorischen Interleukinen und Interferonen dämpft. Weitere JAK-Inhibitoren sind Filgotinib und Upadacitinib.7 Ozanimod, ebenfalls ein small molecule, moduliert die Sphingosin-1-Phosphat(S1P)-Rezeptoren 1 und 5. Dies bewirkt eine Lymphozytenretention in lymphoiden Geweben, was wiederum den Entzündungsprozess abmildert. Mit Etrasimod und Amiselimod werden derzeit zwei weitere S1P-Rezeptormodulatoren für die CED-Therapie untersucht.10,11
Chirurgische Therapie
In den meisten Fällen ist eine chronisch-entzündliche Darmerkrankung mit einer medikamentösen Therapie gut kontrollierbar. Wenn es jedoch trotz Medikamenten zu einer nicht beherrschbaren Krankheitsaktivität kommt, die Medikamente an Wirkung verlieren, Komplikationen wie Fisteln, Blutungen, Abszesse bzw. Stenosen auftreten oder sich Notfallsituationen wie ein Darmverschluss oder Darmdurchbruch ergeben, dann kommt eine Operation als Therapieoption in Betracht oder stellt sogar die einzige mögliche Behandlung dar.12 Dabei ist die Colitis ulcerosa durch eine Kolektomie mit ileoanaler Pouchanlage kurativ behandelbar.13 Beim Morbus Crohn werden Darmresektionen sehr zurückhaltend durchgeführt, da hier operativ keine Heilung möglich ist.13 Die Operationen dienen in erster Linie der Behandlung von Komplikationen, d. h., Abszesse werden entfernt, Fisteln verschlossen und Stenosen erweitert.13 Sehr häufig können die chirurgischen Eingriffe bei einer CED mittels minimal-invasiver Laparoskopie durchgeführt werden, so dass keine den Patienten stärker belastende offene Bauchoperation notwendig ist.12
Apherese
Ein weiterer Therapieansatz ist die Apherese, die vorwiegend bei Colitis ulcerosa mit moderatem, aber auch chronischem, steroidresistentem Verlauf effektiv ist.14 Dabei werden Granulozyten und Monozyten mittels einer Filtersäule, die mit speziellen Zelluloseacetatkügelchen gefüllt ist, aus dem Blut entfernt.15 So können die Entzündungsvorgänge in der Darmschleimhaut positiv beeinflusst werden.
Vorbeugung und Behandlung von CED durch Ernährung
Neben medikamentösen Therapien spielt die Ernährung ebenfalls eine wichtige Rolle bei der Behandlung und auch der Vorbeugung gegen CEDs. So empfiehlt die ESPEN-Leitlinie[1] eine Ernährung, die reich an Obst und Gemüse ist sowie einen hohen Gehalt an Omega-3-Fettsäuren und einen niedrigen Gehalt an Omega-6-Fettsäuren aufweist, um so das Risiko für die Entwicklung einer CED zu reduzieren.16 Sehr stark verarbeitete Lebensmittel und solche, die diätetische Emulgatoren enthalten wie Carboxymethylcellulose, sollten vermieden werden.16 Bei einer aktiven chronisch-entzündlichen Darmerkrankung gibt es keine spezifische «CED-Diät», die generell empfohlen werden kann, um eine Remission zu erreichen.16 Da bei aktiver CED der Proteinbedarf der Patienten jedoch erhöht ist, sollte dies durch eine zusätzliche Proteinzufuhr kompensiert werden.16 Wenn eine medizinische Ernährung bei CED angezeigt ist, dann ist der Einsatz von oralen Nahrungsergänzungsmitteln als unterstützende Therapie zusätzlich zur normalen Nahrung der erste Schritt. Reicht feste Nahrung nicht aus, ist eine enterale Ernährung, bei der die Patienten über eine Sonde oder mit Hilfe von flüssiger Trinknahrung ernährt werden, einer parenteralen Ernährung über einen Venenzugang vorzuziehen.16 Bei leichtem bis mittelschwerem aktivem Morbus Crohn kann eine Ausschlussdiät infrage kommen, bei der Nahrungsmittelbestandteile, die sich negativ auf die Darmbarriere und die Immunreaktion auswirken, in mehreren Stufen eliminiert werden.16 Diese kann durch enterale Ernährung ergänzt werden.16 Generell sind CED-Patienten gefährdet, eine Mangelernährung zu erleiden.16 Sie sollten daher ab dem Zeitpunkt der Diagnose regelmässig darauf hin untersucht und bei Bedarf adäquat behandelt werden.16 Alle CED-Patienten sollten im Rahmen eines multidisziplinären Ansatzes zur Ernährungstherapie eine individuelle Beratung durch einen Diätassistenten erhalten, um ernährungsbedingten Störungen und Mangelernährung vorzubeugen.16
Mikrobiom-basierte Strategien zur Kontrolle von CEDs
Das Darm-Mikrobiom gilt als ein wichtiger Faktor in der Pathogenese von CEDs.2 Es wird vermutet, dass eine Abnahme der Mikrobiom-Diversität ein Ungleichgewicht zwischen nützlichen und schädlichen Bakterien verursacht (Dysbiose), was wiederum das Mikrobiom schädigt und damit die Anfälligkeit der Mikroumgebung für die Entwicklung einer CED erhöht.2 So wurde in zahlreichen Studien bei CED-Patienten eine Mikrobiom-Dysbiose im Vergleich zu Gesunden nachgewiesen.17 Vor diesem Hintergrund gilt die Abschwächung oder Umkehrung dieses mikrobiellen Ungleichgewichts als mögliche therapeutische Strategie bei CEDs, mit der sich die Entzündung der Darmschleimhaut abschwächen lässt.17 In Tabelle 2 sind die aktuellen Mikrobiom-basierten Behandlungsansätze und ihre Wirkung auf das Mikrobiom zusammengefasst.17 In der Schweiz ist das Probiotikum E. coli Stamm Nissle 1917 bei Colitis ulcerosa in der Remissionsphase zugelassen.18
Die ESPEN-Leitlinie empfiehlt eine probiotische Therapie bei milder bis moderater Colitis ulcerosa als Alternative zur Standardtherapie mit 5-ASA, wenn diese nicht vertragen wird.16 Bei Morbus Crohn wird der Einsatz eines Probiotikums hingegen nicht empfohlen. Präbiotika und Antibiotika können gemäss Leitlinie derzeit weder bei Morbus Crohn noch bei Colitis ulcerosa zur Behandlung einer aktiven Erkrankung oder zum Remissionserhalt routinemässig empfohlen werden. Bei einer akuten Pouchitis kommen die Antibiotika Ciprofloxacin (erste Wahl) und Metronidazol als Ersttherapie infrage. Eine Empfehlung für oder gegen den Einsatz einer FMT-Therapie bei einer CED kann gemäss Leitlinie derzeit aufgrund fehlender Evidenz nicht gegeben werden.
Behandlung der Colitis ulcerosa
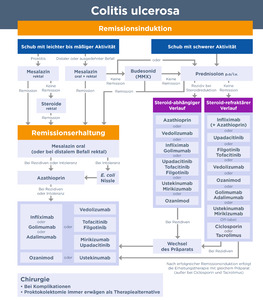
Für die Therapieentscheidung bei einer CU spielen verschiedene Faktoren eine Rolle. Hierzu gehören die Schwere der Erkrankung, das endoskopische Befallsmuster, das Patientenalter, das Ansprechen auf vorherige Therapien, mögliche extraintestinale Manifestationen sowie die jeweilige Patientenpräferenz.7 Abbildung 2 zeigt einen Algorithmus für die Vorgehensweise beim Therapiemanagement der Colitis ulcerosa.19
Die IG-IBD[2] empfiehlt in ihrer Leitlinie für erwachsene Patienten mit mittelschwerer bis schwerer Colitis ulcerosa, die auf eine konventionelle Therapie nicht ansprechen und Biologika-naiv sind, den Einsatz von Infliximab, Adalimumab, Golimumab, Vedolizumab, Ustekinumab oder Tofacitinib, um eine Remission herbeizuführen.20 Dabei wird die Anwendung von Infliximab auf der Basis von indirekten Vergleichsdaten gegenüber Adalimumab und Golimumab bevorzugt.20 In dieser Therapiesituation ist gemäss der Leitlinie auch Vedolizumab gegenüber Adalimumab zu bevorzugen, da dies bei der Aufrechterhaltung der Remission überlegen ist.20 Ansonsten können aufgrund mangelnder Evidenz keine Aussagen zur Reihenfolge der Therapien bei Biologika-naiven Patienten getroffen werden.20 Bei erwachsenen Patienten mit mittelschwerer bis schwerer Colitis ulcerosa, die gegenüber mindestens einem Biologikum refraktär sind, schlägt die IG-IBD die Verwendung von Tofacitinib oder Ustekinumab zur Induktion einer Remission vor.20 Erwachsene Patienten mit Colitis ulcerosa, die eine Remission mit Infliximab, Adalimumab, Vedolizumab, Ustekinumab oder Tofacitinib erreicht haben, sollten dasselbe Medikament zur Erhaltungstherapie verwenden.20
Behandlung des Morbus Crohn
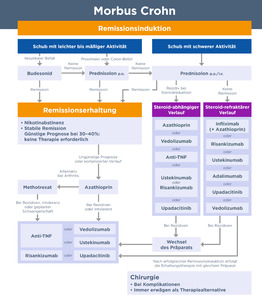
Die Behandlung von MC-Patienten ist komplex, da die Wahl der Therapie von etlichen Faktoren abhängt.21 Hierzu gehören Ort und Schwere der Entzündung, Krankheitsverlauf (entzündlich, verengend oder penetrierend), aber auch Komorbiditäten, extra-intestinale Manifestationen, das Patientenalter und frühere Behandlungen.21 Abbildung 3 zeigt einen Algorithmus für die Vorgehensweise beim Therapiemanagement des Morbus Crohn.19
Die IG-IBD empfiehlt in ihrer Leitlinie, erwachsene Patienten mit mittelschwerem bis schwerem Morbus Crohn, die auf konventionelle Therapien nicht ansprechen und Biologika-naiv sind, mit Infliximab, Adalimumab, Vedolizumab oder Ustekinumab zu behandeln, um eine Remission einzuleiten.22 Dabei wird aufgrund mangelnder Evidenz keine Empfehlung zur Präferenz einzelner Biologika ausgesprochen.22 Zur Remissionsinduktion sollte laut Leitlinie jedoch eher eine Kombinationstherapie aus Infliximab plus Immunsuppressivum als eine Infliximab-Monotherapie eingesetzt werden.22 Bei Patienten mit mittelschwerem bis schwerem Morbus Crohn, die gegenüber mindestens einem Biologikum refraktär sind, empfiehlt die IG-IBD eine Behandlung mit Adalimumab, Vedolizumab oder Ustekinumab zur Einleitung einer Remission.22 Erwachsene Patienten mit Morbus Crohn, die unter Infliximab, Adalimumab, Vedolizumab oder Ustekinumab eine Remission erreicht haben, sollten dasselbe Medikament als Erhaltungstherapie verwenden.22
Extraintestinale Manifestationen bei CEDs und ihre Behandlung
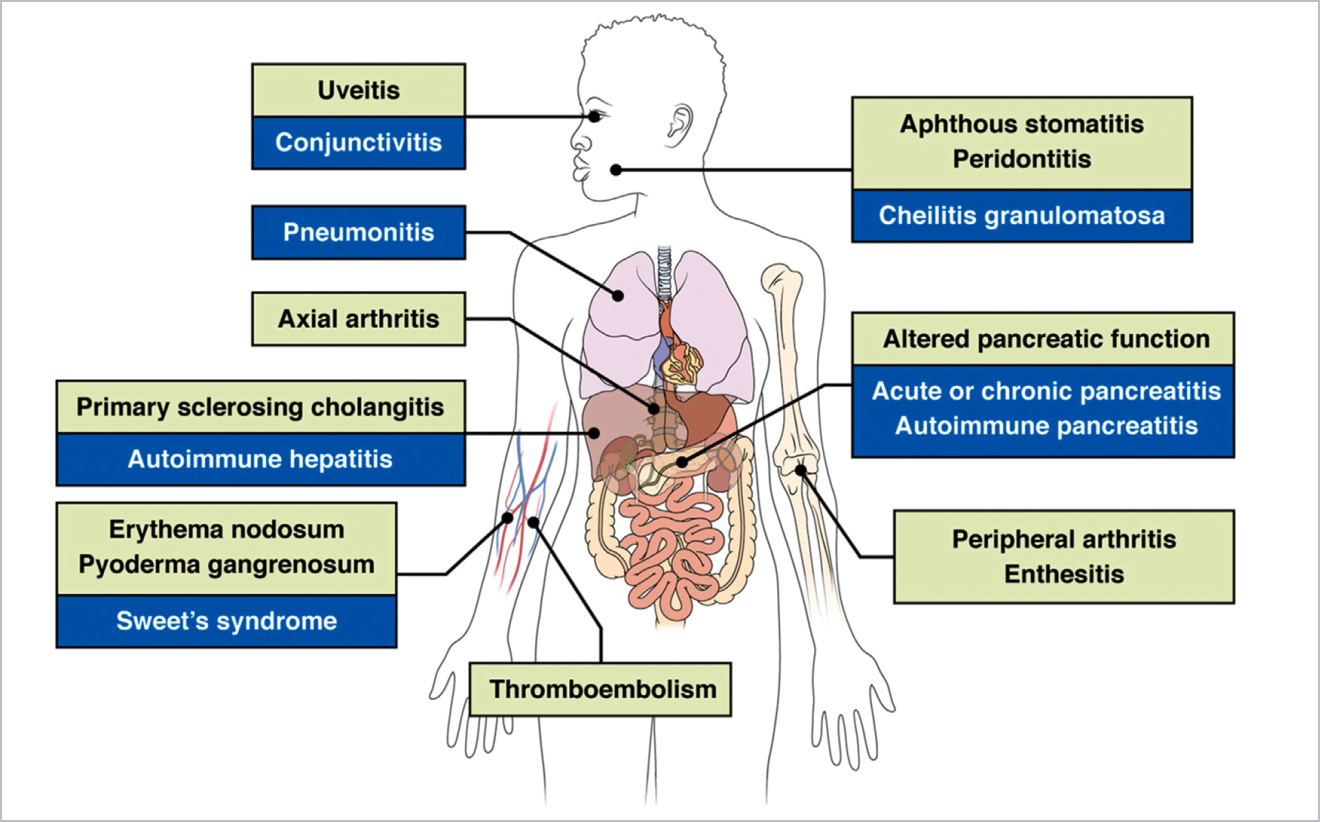
Chronisch-entzündliche Darmerkrankungen betreffen nicht nur den Magen-Darm-Trakt, sondern können sich auch auf viele andere Organe des Körpers negativ auswirken.23,24 Diese Beeinträchtigungen ausserhalb des Gastrointestinaltrakts werden als extraintestinale Manifestationen (EIMs) bezeichnet.23,24 EIMs sind sowohl bei der Colitis ulcerosa als auch beim Morbus Crohn weit verbreitet.23,24 Am häufigsten sind Muskeln und Skelett (9–53 %) sowie die Haut (2–34 %) betroffen, aber auch Augen, Leber, Gallenblase und Pankreas sowie Nieren und Lungensystem können beeinträchtigt sein (Abbildung 4).23,24
Die Therapiewahl ist abhängig von der Art der EIM. Dabei sind periphere Arthritis, orale aphthöse Geschwüre, Episkleritis und Erythema nodosum häufig mit einem Krankheitsschub assoziiert und können sich daher im Rahmen der CED-Behandlung verbessern.24 Andere EIMs wie Uveitis, ankylosierende Spondylitis und primär sklerosierende Cholangitis treten in der Regel unabhängig von der Krankheitsaktivität auf, d. h., hier wird sich eine erfolgreiche Therapie der intestinalen Entzündung nicht unbedingt positiv auf den Krankheitsverlauf der EIM auswirken.24 Was die Behandlung im Einzelnen betrifft, so kommen z. B. bei der peripheren Arthritis COX-2-Hemmer, Kortikosteroide (kurzzeitig), Sulfasalazin (insbesondere bei Colitis ulcerosa), Methotrexat und TNF-α-Hemmer zum Einsatz.24 Eine Uveitis wird zunächst mit Kortikosteroid-haltigen Augentropfen behandelt.24 Wenn das nicht erfolgreich ist, werden systemische Steroide, Immunsuppressiva wie Azathioprin oder TNF-α-Inhibitoren angewendet.24 Eine Pyoderma gangraenosum kann mit systemischen Glukokortikoiden, Cyclosporin, Tacrolimus oder TNF-α-Inhibitoren behandelt werden. Bei einer PSC[3] sollten Gallenblasenpolypen durch Cholezystektomie entfernt werden, da sie ein hohes malignes Potential besitzen.24 Neben TNF-α-Inhibitoren können auch andere Biologika bei EIMs erfolgreich eingesetzt werden. So wurde in einer retrospektiven Real-World-Studie mit 99 Patienten, die an CU oder MC erkrankt waren, gezeigt, dass nach 12-monatiger Behandlung mit Vedolizumab die EIMs insgesamt in 25,3 % der Fälle verschwunden waren.25 Bei 49,5 % der Patienten konnte eine Verbesserung der extraintestinalen Manifestationen beobachtet werden. Letztlich sind spezifische antiinflammatorische bzw. symptomatische Therapieansätze notwendig, um EIMs adäquat zu behandeln und so die Lebensqualität der Patienten zu verbessern.23,24 Dabei wird ein multidisziplinärer Ansatz unter frühzeitiger Einbeziehung von Spezialisten empfohlen.23,24
Fistelnder Morbus Crohn
Perianale Fisteln, d. h. entzündlich veränderte Gänge im Bereich der Analregion, gehören zu den schwierigsten Komplikationen beim Morbus Crohn und können die Lebensqualität der Betroffenen erheblich einschränken.26 Die Prävalenz beträgt bei erwachsenen MC-Patienten etwa 20 %.26 Perianale Fisteln lassen sich in einfache oder komplexe Fisteln einteilen.27 Einfache Fisteln sind oberflächlich gelegen, inter- oder tief transsphinkterisch und weisen nur eine Öffnung auf, die weder mit einem Abszess noch einer angrenzenden Struktur verbunden ist (Abbildung 5).27 Im Gegensatz dazu betreffen komplexe Fisteln einen grösseren Teil des Schliessmuskels (hoch transsphinkterisch, extrasphinkterisch, oder suprasphinkterisch), weisen mehrere Öffnungen auf, und sind mit einem Abszess und/oder einer angrenzenden Struktur verbunden (Abbildung 5).27 Rund 70–80 % der perianalen Fisteln bei Morbus Crohn gelten als komplex.28 Diese Fisteln sind oft schwer zu behandeln und sprechen nur schlecht auf medikamentöse Therapien an. Ein chirurgischer Eingriff ist häufig die einzige Behandlungsmöglichkeit.
Die Therapie von perianalen Fisteln sollte in interdisziplinärer Abstimmung erfolgen, wobei häufig ein kombinierter Ansatz (medikamentös und chirurgisch) indiziert ist.30 Zur medikamentösen Behandlung von komplexen perianalen Fisteln beim Morbus Crohn empfiehlt die DGVS[4] in ihrer Leitlinie nach Abszessausschluss oder -drainage den Einsatz von Infliximab als primäre Therapie.30 Infliximab ist in der Schweiz auch ausdrücklich zur Behandlung von Morbus Crohn mit schwerwiegender Fistelbildung zugelassen.31 Adalimumab kann nachrangig ebenfalls bei komplexen Fisteln verwendet werden.30 Antibiotika können eingesetzt werden, um kurzfristig die Fistelsekretion und die klinischen Beschwerden zu verbessern.30 Müssen perianale Fisteln chirurgisch behandelt werden, stehen dafür verschiedene Verfahren zur Verfügung. Hierzu gehören26,32:
-
Fadeneinlage (Seton): Bei dieser Methode werden dünne Fäden, sogenannte Setons, in die Fistel eingebracht, so dass das Sekret kontinuierlich nach aussen abfliessen kann. Die Fadeneinlage eignet sich auch bei komplexen Analfisteln oder zur dauerhaften Drainage. Die Behandlung ist einfach und effektiv mit einer Gesamterfolgsrate von 87,5 % und erhält die Funktion des analen Schliessmuskels.
-
Fistelspaltung (Fistulotomie): Hier wird die perianale Fistel der Länge nach aufgeschnitten. Diese Technik ist bei einfachen, oberflächlich gelegenen perianalen Fisteln die häufigste Behandlungsmethode. Bei komplexen Fisteln kann es zur dauerhaften Schädigung der Schliessmuskeln und in der Folge zur Stuhlinkontinenz kommen. Die Langzeit-Rezidivrate bei dem Verfahren ist mit 39 % nach 72 Monaten relativ hoch.
-
Advanced Mucosa Flap: Bei dieser Operationstechnik wird die Fistel aus dem Gewebe herausgeschnitten bis zu der Stelle, an der sie den Schliessmuskel durchdringt. Die innere Öffnung im Darm wird direkt zugenäht und zusätzlich mit einem Schleimhautlappen abgedeckt. Die Methode wird vorwiegend bei transphinkterischen Analfisteln angewendet. In einer Meta-Analyse mit 135 Patienten konnte mit diesem Verfahren eine klinische Heilungsrate von 66 % erzielt werden, wobei die Rezidivrate 30 % betrug.33
-
Fistelverschluss mittels LIFT[5]: Bei dieser Methode wird der Verbindungsgang zwischen dem inneren und äusseren Schliessmuskel durchtrennt. Der äussere Anteil des Fistelgangs wird dann bis zum Sphinkter entfernt. Diese Operationstechnik eignet sich nur für Analfisteln, die durch den inneren und äusseren Schliessmuskel ziehen (transsphinktere Analfisteln). In einer prospektiven Studie konnte nach zwei Monaten eine klinische Heilungsrate von 60 % erzielt werden.34
-
Injektion von Fibrinkleber: Fibrinkleber aktiviert Thrombin zur Bildung eines Fibringerinnsels, das die Perianalfistel mechanisch verschliesst. Auf Dauer löst sich das Fibringerinnsel auf und der Gewebeheilungsprozesses wird gefördert. In einer Studie wurde nach 8 Wochen eine klinische Remissionsrate von 38 % erreicht.35 Die Verwendung von Fibrinkleber kann vor invasiveren Eingriffen bei Patienten mit komplexen Fisteln ausprobiert werden.
-
Analer Fistelzapfen: Hierbei wird ein Zapfen in die Fistel eingebracht, der aus einem Gewebe besteht, das dem Dünndarm von Schweinen entstammt. Dieser Zapfen stützt die Struktur, bietet eine Möglichkeit zur Zellanhaftung und fördert die Heilung des Gewebes. In einer Studie konnte mit der Technik nach 12 Wochen eine Fistelverschlussrate von 31,5 % gegenüber 23,1 % mit einer Fadeneinlage erzielt werden.36,37
Eine weitere Behandlungsmethode für perianale Fisteln ist der Einsatz von Stammzellen, die ein entzündungshemmendes und immunmodulierendes Potenzial besitzen. So untersuchte ADMIRE-CD die Sicherheit und Wirksamkeit von Darvadstrocel, einem Präparat aus adulten allogenen mesenchymalen Stammzellen.38 In die Phase-III-Studie wurden 212 Patienten mit Morbus Crohn und komplexen perianalen Fisteln eingeschlossen. Nach minimal-invasiver chirurgischer Behandlung der Fisteln wurde ihnen Darvadstrocel oder Placebo um die innere Fistelöffnung und um den Fistelgang injiziert. Die Auswertung der Langzeitdaten von 37 verbliebenen Patienten nach 104 Wochen ergab einen Fistelverschluss bei 56 % der Patienten in der Darvadstrocel-Gruppe gegenüber 40 % in der Kontrollgruppe. In der Schweiz ist Darvadstrocel unter bestimmten Voraussetzungen zur Therapie von Morbus Crohn-assoziierten komplexen perianalen Fisteln zugelassen.39
Interessenskonflikt
Der Autor erklärt, dass das Manuskript ohne jegliche kommerzielle oder finanzielle Unterstützung verfasst wurde, die als potenzieller Interessenskonflikt ausgelegt werden könnte.
Finanzierung
Der Autor erklärt, keine finanzielle Unterstützung von einer Organisation für die eingereichte Arbeit erhalten zu haben.
Autorenbeiträge
Der Autor hat das Manuskript verfasst und es genehmigt.
ESPEN: The European Society for Clinical Nutrition and Metabolism
IG-IBD: Italian Group for the Study of Inflammatory Bowel Disease
PSC: primär sklerosierende Cholangitis
DGVS: Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten
LIFT: Ligation of Intersphincteric Fistula Tract