Einleitung
Eisenmangel (EM) ist ein weit gefasster Begriff, der sich entweder auf niedrige Eisenspeicher bezieht, die den Eisenbedarf des Körpers nicht decken (absoluter Eisenmangel), oder auf eine Störung, bei der die Eisenversorgung des Knochenmarks nicht ausreicht (funktioneller Eisenmangel).1 EM kann die Patienten schwächen und zugrunde liegende chronische Erkrankungen (z. B. chronische Niereninsuffizienz (CKD), Herzinsuffizienz (HF), entzündliche Darmerkrankungen (IBD)) verschlimmern, was letztlich die Morbidität und Mortalität erhöht.2 Patienten mit EM weisen häufig unspezifische klinische Symptome wie Erschöpfung, verminderte Leistungsfähigkeit, Produktivitätsverlust und eingeschränkte Lebensqualität auf (QoL).3 Bei Frauen im gebärfähigen Alter ist das EM-Risiko aufgrund des menstruellen Blutverlusts und des erhöhten Eisenbedarfs während der Schwangerschaft und Geburt wesentlich höher als bei Männern.3 Die Prävalenz des EMs in Europa wird auf 10–30 % geschätzt.4
Die Eisenmangelanämie (EMA) ist die Spätmanifestation eines schwerwiegenden EMs, der die Erythropoese soweit einschränkt, dass der Hämoglobinwert bei Männern unter 130 g/l, bei nicht schwangeren Frauen (ab 15 Jahren) unter 120 g/l und bei schwangeren Frauen unter 110 g/l fällt.1 Zu den Risikofaktoren für einen EM resp. eine EMA zählen neben dem weiblichen Geschlecht auch HF, CKD, Krebs, Restless-Leg-Syndrom (RLS), IBD und andere chronische Magen-Darm- und Lebererkrankungen.3 So sind schätzungsweise 37–61 % der Patienten mit chronischer HF und 24–85 % der Patienten mit CKD von einem EM betroffen.2 Ähnlich wie bei der HF können EM bei CKD durch chronische Entzündungen noch verschlimmert und die klinische Verschlechterung beschleunigt werden.2 Die Ätiologie des EMs kann meist auf Entzündungen, Mangelernährung, Malabsorption, erhöhten Eisenverlust oder -bedarf sowie auf bestimmte Medikamente zurückgeführt werden.1,5 Häufig liegen jedoch mehrere Ursachen des EMs gleichzeitig vor.5 Die anerkannte Behandlung sowohl des EMs als auch der EMA ist die Eisensubstitution, die sowohl die orale als auch die intravenöse Eisensupplementierung umfasst.3 Obwohl der EM ohne Anämie und auch die EMA häufige allgemeinmedizinische Erkrankungen sind, ist deren Diagnose aufgrund der unspezifischen Symptomatik schwierig.3 Ausserdem fehlen in den bestehenden Leitlinien praktische Empfehlungen für Hausärzte zur Diagnose und Behandlung des EMs ohne Anämie und der EMA.3 Normalerweise kann der Eisenstatus durch die Messung des Ferritinspiegels im Serum ausreichend ermittelt werden.3 Allerdings ist Ferritin ein Akutphasenprotein, dessen Spiegel als Reaktion auf infektiöse und andere entzündliche Prozesse sowie Lebererkrankungen ansteigt, was die Diagnose erschwert.3 Tatsächlich besteht das Risiko, dass in der Primärversorgung der EM nicht erkannt und somit nicht behandelt wird, insbesondere im Zusammenhang mit Begleiterkrankungen einschliesslich entzündlicher Erkrankungen wie z. B. HF.6
Kürzlich haben Schweizer Experten unter Berücksichtigung der Tatsache, dass für die Erkennung und Diagnose des EMs/der EMA in erster Linie die Hausärzte zuständig sind, die Delphi-Methodik angewandt, um einen Konsens bezüglich der Diagnose und Behandlung des EMs/der EMA zu erzielen.3 Bei Patienten ohne systemische Entzündung wird ein Serumferritin-Grenzwert von 30 µg/l empfohlen, während der empfohlene Wert für Patienten mit chronisch-entzündlicher Erkrankung bei 100 µg/l (oder höher je nach Grundpathologie) liegt.3 Bei Patienten mit chronischen Erkrankungen wird die Routinekontrolle des Serumferritins empfohlen, bevor sich eine Anämie anbahnt; die Behandlung des EMs bei diesen Patienten basiert auf höheren Ferritingrenzwerten entsprechend den jeweiligen krankheitsspezifischen Leitlinien.3
Vor diesem Hintergrund und um zu verstehen, wie EM und EMA derzeit hausärztlich in der Schweiz diagnostiziert und behandelt werden, führten wir eine Erhebung zur gängigen Praxis unter Schweizer Hausärzten durch. Die Ergebnisse der Auswertung werden in diesem Beitrag vorgestellt.
Methodik
Die Datenerfassung für diese Erhebung erfolgte von Januar 2020 bis Juli 2021 durch 96 Schweizer Hausärzte (72 % aus der Deutschschweiz, 21 % aus der Westschweiz und 7 % aus dem Tessin). Um einen Bias zu vermeiden, konnten maximal 5 Patienten pro Hausarzt eingeschlossen werden. Die Daten wurden von Patienten erhoben, bei denen im Rahmen der Grundversorgung ein EM/eine EMA diagnostiziert worden war. In die Umfrage wurden Patienten aufgenommen, welche eine IV-Eisensubstitution aufgrund von Eisenmangel mit oder ohne Anämie erhielten. Es wurden keine zusätzlichen Untersuchungen durchgeführt und die Entscheidung des Arztes, ob eine Eisensupplementation durchgeführt werden sollte oder wie diese durchzuführen war, erfolgte unabhängig von dieser Erhebung.
Die Daten wurden bei zwei Arztbesuchen erfasst. Bei der ersten Konsultation vor der IV-Eisentherapie wurden die Charakteristika und demografischen Daten der Patienten, die Laborparameter, die Intensität der klinischen Symptome (auf einer Scala von 0–4; 0=keine, 1=leichte, 2=mittlere, 3=starke, 4=sehr starke Symptomatik) und der Grund für den Wechsel zur IV-Therapie oder die Wahl einer IV-Verabreichung als Ersttherapie dokumentiert. Bei den Gründen zur Wahl der IV-Verabreichung (nach Wechsel oder bei Ersttherapie) sowie bei Angabe der Symptome waren Mehrfachnennungen möglich. In einer zweiten Konsultation, welche im Median 8 Wochen später stattfand (Q1, Q3: 4, 9 Wochen), wurden erneut die klinischen Symptome und Laborparameter dokumentiert sowie der Therapieerfolg erfasst. Die Auswertung erfolgte rein deskriptiv.
Bei der Dateneingabe hatte der Arzt die Möglichkeit anzugeben, welche der folgenden Laborparameter gemessen wurden: Hämoglobin (Hb), Ferritin, löslicher Transferrinrezeptor (sTfR), Transferrinsättigung (TSAT), mittleres korpuskuläres Hämoglobin (MCV), mittlere korpuskuläre Hämoglobinkonzentration (MCHC) und C-reaktives Protein (CRP). In der ersten Konsultation konnten die Ärzte des Weiteren angeben, ob 1) zunächst eine orale Behandlung verschrieben worden war, und 2) aus welchem Grund sie auf eine intravenöse Therapie gewechselt hatten, oder (wenn 1 und 2 mit Nein beantwortet wurden), 3) aus welchem Grund sie direkt eine intravenöse Therapie verordnet hatten.
Resultate
Welche Art von Patienten mit Eisenmangel/Eisenmangelanämie, die eine IV-Therapie erhalten, werden in der Schweiz hausärztlich diagnostiziert?
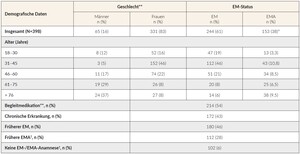
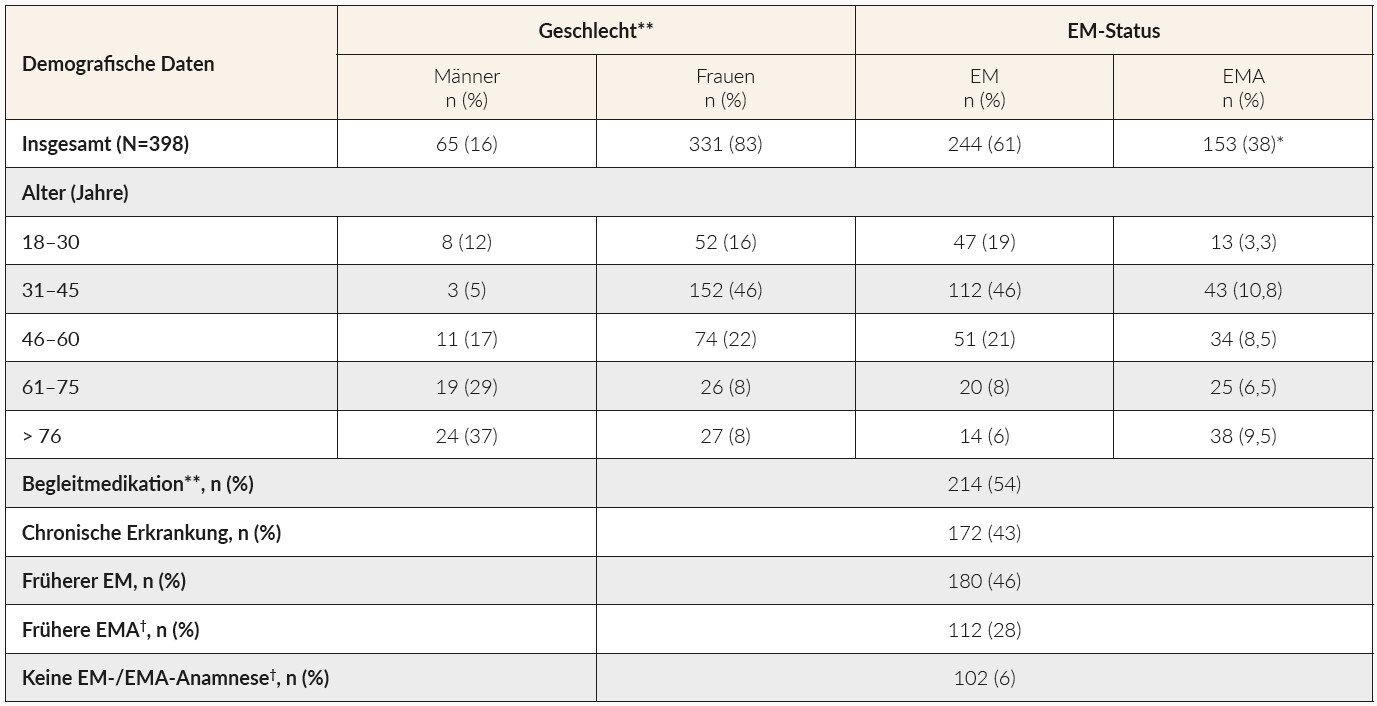
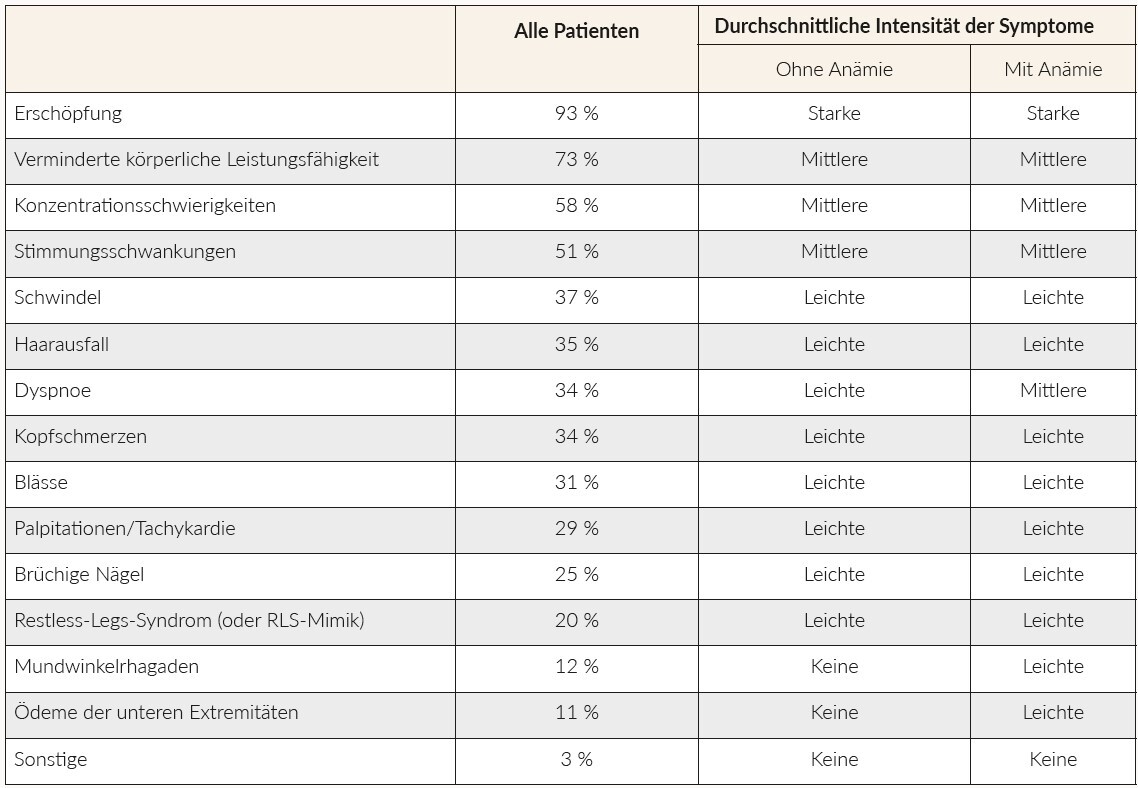
Insgesamt wurden die Daten von 398 Patienten dokumentiert (Tabelle 1). In die Erhebung eingeschlossen wurden lediglich Daten von Patienten, die eine IV-Therapie erhielten. Bei den meisten Patienten, die ihren Hausarzt aufsuchten (67 %), wurde die Diagnose aufgrund der vorliegenden Symptomatik gestellt, während sich bei 19 % die Diagnose bei einer Routinekontrolle ergab. Weitere Gründe für eine Diagnosestellung waren: Überprüfung auf Patientenwunsch (25 %), Grunderkrankung(en) (11 %) und Zuweisung durch Facharzt (10 %). Von den während einer Routineuntersuchung diagnostizierten Patienten waren 33 % älter als 61 Jahre und 55 % litten an einer chronischen Erkrankung. Die am häufigsten berichteten mässig- bis schwergradigen Symptome (Grad 2 bis 4) des EMs/der EMA waren Erschöpfung (93 %), verminderte körperliche Leistungsfähigkeit wie Schwierigkeiten beim Treppensteigen (73 %), Konzentrationsschwierigkeiten (58 %), und Stimmungsschwankungen (51 %). Insgesamt ähnelte sich die durchschnittliche Intensität der Symptome bei Patienten mit EM bzw. EMA, wobei Rhagaden, Dyspnoe und Ödeme nur bei Patienten mit EMA auftraten (Übersicht der Symptome: siehe Tabelle 2).
Jeder vierte Patient (24,1 %), bei dem ein EM/eine EMA diagnostiziert wurde, war über 61 Jahre alt, und davon waren die meisten anämisch. Etwa die Hälfte der Patienten erhielt Begleitmedikamente (54 %), unter ihnen waren 44 % über 61 Jahre alt. An einer chronischen Grunderkrankung litten darüber hinaus 43 % der Befragten, von denen 52 % über 61 Jahre alt waren.
Welches sind die Hauptursachen des EMs/der EMA in dieser Erhebung?
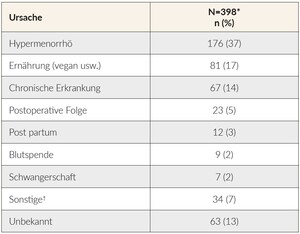
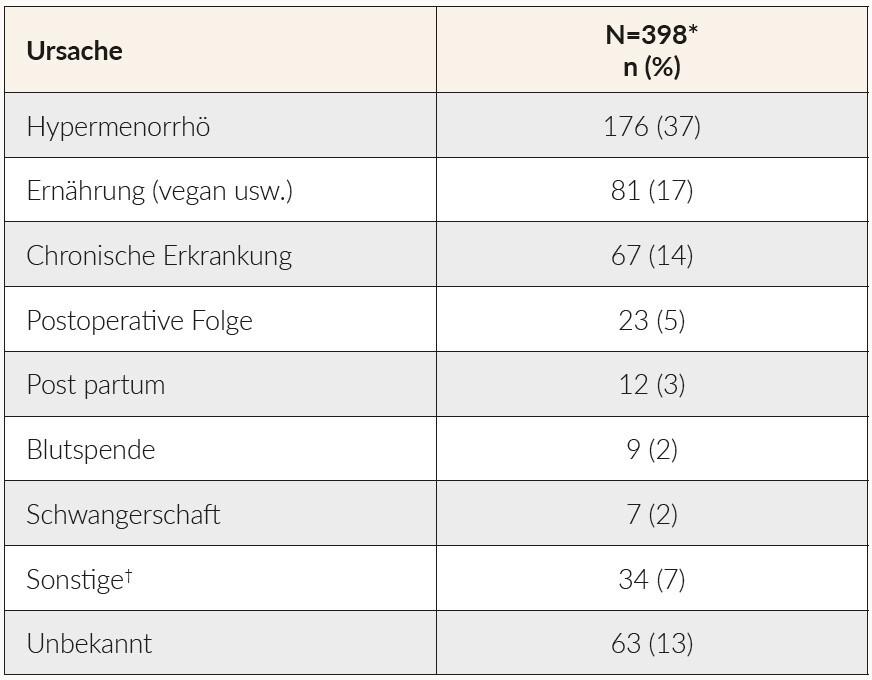
Die Hauptursachen des/der von schweizerischen Hausärzten angegebenen EMs/EMA in dieser Untersuchung sind in Tabelle 3 aufgeführt. Die Ergebnisse belegen, dass die zweitwichtigste von Hausärzten genannte Ursache des EMs/der EMA die Ernährung ist. Chronische Erkrankungen wurden als drittwichtigste Ursache des EMs/der EMA genannt.
Welche Laborwerte werden in der Schweizer Hausarztpraxis zur Diagnose des EMs/der EMA bestimmt?
Bei mehr als 80 % der Patienten wurden Hb, Ferritin, MCV und MCHC untersucht. Darüber hinaus wurde bei mehr als 70 % der Patienten auch das CRP gemessen (Tabelle 4). Etwa 11 % der Hausärzte bestimmen das CRP und Ferritin nicht gleichzeitig. Die Auswertung dieser Studie ergab, dass 2 % bzw. 7 % der Hausärzte den MCV- und MCHC-Wert nicht bestimmen.
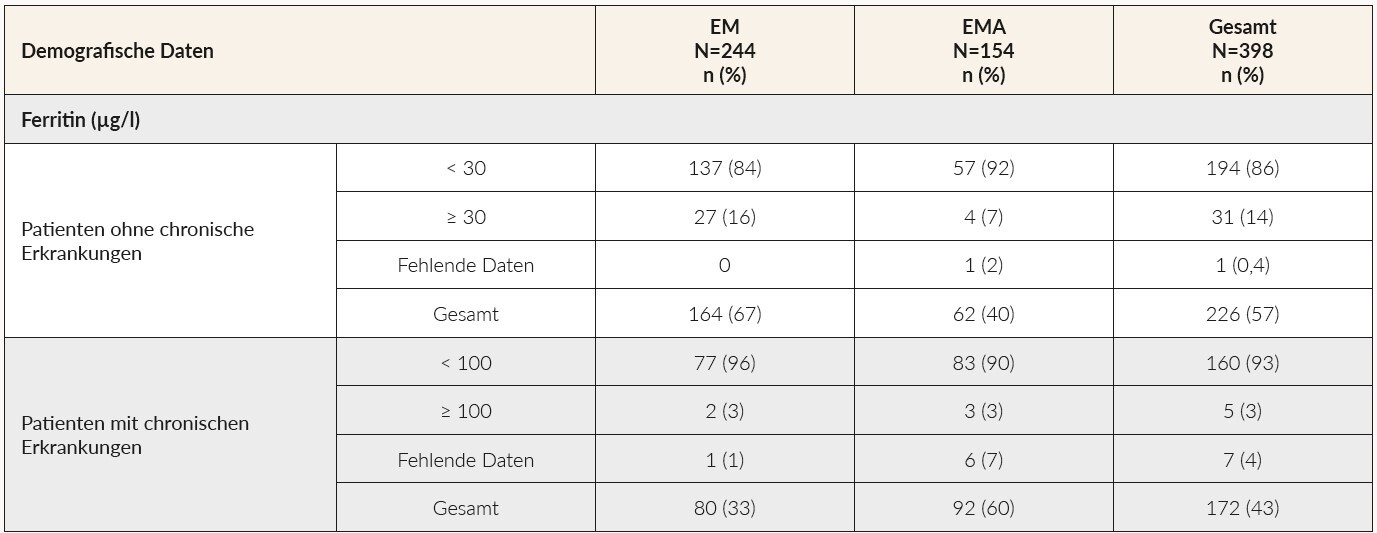
Tabelle 5 gibt einen Überblick über die Höhe der gemessenen Ferritinwerte stratifiziert nach Patienten mit und ohne chronische Erkrankungen. Der Grossteil der Patienten ohne chronische Erkrankung hat einen EM ohne Anämie (67 %; 86 % Ferritin < 30 µg/l), während die meisten Patienten mit einer chronischen Erkrankung einen EM mit Anämie (60 %; 93 % Ferritin < 100 µg/l) aufweisen. Insgesamt wiesen 5 % der Patienten in der Studie einen Ferritinwert von über 50 µg/l auf und 3 % von über 100 µg/l.
Bestimmung des Ferritinspiegels
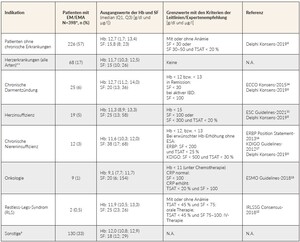
Insgesamt haben die meisten Patienten in dieser Erhebung leere Eisenspeicher (i.e., Ferritin < 30 µg/l; Median 18,0 µg/l; Q1, Q3 Spannbreite: 11,0; 22,0). Patientinnen im Alter zwischen 18 und 60 Jahren mit oder ohne chronische Erkrankung hatten einen mittleren Ferritinspiegel von 12,5–15,5 bzw. 13,0–13,5 µg/l, während der mediane Ferritinspiegel bei Frauen im Alter ab 61 Jahren 19,0–21,0 bzw. 16,0–18,0 µg/l betrug. Bei männlichen Patienten im Alter zwischen 18 und 60 Jahren mit oder ohne chronische Erkrankung lag der mediane Ferritinspiegel bei 12,0–89,0 bzw. 18,1–23,0 µg/l, während der mediane Ferritinspiegel bei Männern im Alter ab 61 Jahren 13,0–20,0 bzw. 23,0–47,5 µg/l betrug. Die Diagnose sowie die Ausgangsparameter der Hb und SF bei allen Patienten, unabhängig von Alter und Geschlecht, sind in Tabelle 6 zusammengefasst. Ausserdem zeigt die Tabelle die Grenzwerte in Abhängigkeit zugrundeliegender Erkrankungen (Indikation) des Patienten und des Vorliegens einer Anämie, im Vergleich mit den Kriterien der Leitlinien/Expertenempfehlungen.
TSAT-Bestimmung
In dieser Studie wurde die TSAT von den Hausärzten selten gemessen, insbesondere nicht bei Patienten mit chronischen Erkrankungen; die Schweizer Hausärzte bestimmten die TSAT bei 17 % bzw. 12 % der Patienten mit bzw. ohne chronische Erkrankung (Tabelle 4).
Wann verschreiben Schweizer Hausärzte eine IVES anstelle der OES für EM-/EMA-Patienten?
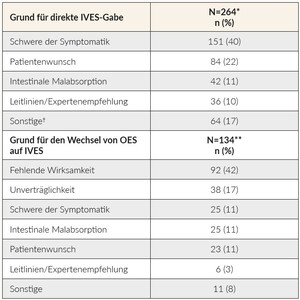
Etwa 25 % der an der Studie teilnehmenden Patienten erhielten eine primäre orale Eisensupplementierung (OES) mit einer durchschnittlichen Behandlungsdauer von 8,0 Wochen (Q1, Q3: 4,0 bis 12,0 Wochen), vor dem Wechsel auf eine IV-Verabreichung. Die Gründe, warum Hausärzte auf IVES für EM-/EMA-Patienten umstellten oder direkt nutzten, sind in Tabelle 7 aufgeführt. Interessanterweise bat ein beträchtlicher Prozentsatz der Patienten (22 %) ausdrücklich um eine IVES-Behandlung, wobei es sich mehrheitlich um jüngere Patienten im Alter zwischen 18 und 45 Jahren ohne chronische Erkrankung handelte (57 % bzw. 61 %).
Berechnung der Gesamteisendosis
Fast die Hälfte der Hausärzte gab an, die Gesamteisendosis anhand der Ganzoni-Formel zu berechnen, 20 % nutzten einen Online-Rechner (www.iron.medline.ch) und 31 % schätzten die Gesamteisendosis auf der Grundlage früherer Erfahrungen. Dennoch gaben 9 % der befragten Hausärzte an, dieses Hilfsmittel bei Patienten mit chronischen Erkrankungen einzusetzen.
Wirksamkeit der Behandlung
Die Veränderung der Häufigkeit schwerer klinischer Symptome nach der intravenösen Eisensupplementierung wurde untersucht. Alle Symptome waren nach durchschnittlich 5 Wochen Eisenbehandlung deutlich rückläufig. In Bezug auf die Müdigkeit hatten 79 % der Patienten vor der Behandlung eine starke oder sehr starke Symptomatik, nur 7 % nach der Behandlung. Nach Ansicht der Ärzte wurde das Therapieziel bei 74,4 % der Patienten erreicht. Zur Überprüfung des Therapieerfolgs anhand der Blutwerte haben 82 % der Hausärzte das Hb gemessen, 78 % das Ferritin, 77 % den MCV, 67 % den MCHC und 69 % das CRP, der sTfR und die TSAT wurden bei weniger als 13 % der Hausärzte kontrolliert.
Diskussion/Ausblick
Allgemeines, Demografie und Ursachen von EM/EMA
Der vorliegende Bericht beschreibt die Diagnostik und den Therapieverlauf bei Patienten mit einem Eisenmangel/einer Eisenmangelanämie, die eine intravenöse Eisensupplementation erhielten, bei Schweizerischen Hausärzten. Diese Studie legt nahe, dass die EM-/EMA-Patientengruppe nicht nur auf gesunde, junge Frauen im gebärfähigen Alter beschränkt ist. Jeder vierte Patient mit EM-/EMA-Diagnose war erstaunlicherweise älter als 61 Jahre, was bestätigt, dass der EM/die EMA auch bei älteren Frauen und Männern ein Problem darstellt.7 Knapp die Hälfte (43 %) der diagnostizierten Patienten hatten eine chronische Erkrankung.
Unsere Studienergebnisse zeigen, dass die Ernährung als zweitwichtigste Ursache des EMs/der EMA ist von Hausärzten angegeben wird. Ein Jahrzehnt zuvor wurde in einer anderen Beobachtungsstudie die Ernährung nur bei 6 % der Patienten als ursächlich für EM/EMA angesehen.8 Dieses Ergebnis deckt sich mit Angaben aus der Literatur, die darauf hindeuten, dass vegetarische und vegane Ernährung in der schweizerischen Bevölkerung in den letzten Jahren zugenommen hat.9 Chronische Erkrankungen wurden von Hausärzten als die dritthäufigste Ursache des EMs/der EMA genannt. Dies könnte möglicherweise auf ein gestiegenes Bewusstsein für die zugrundeliegenden pathologischen Ursachen des EMs hinweisen.2
In den letzten zehn Jahren haben Erkenntnisse aus der Literatur und Leitlinien von Gesellschaften, z. B. der Europäischen Gesellschaft für Kardiologie (ESC 2021),10 der Internationalen Studiengruppe Restless Legs (IRLSSG 2018),11 der Europäischen Gesellschaft für Medizinische Onkologie (ESMO 2018)12 und der Europäischen Organisation für Morbus Crohn und Colitis (ECCO 2015)13 die Rolle des EMs bei verschiedenen Erkrankungen wie chronischer Herzinsuffizienz, RLS, Krebs und IBD betont.3 Die Tatsache, dass ein signifikanter Anteil der EM-/EMA-Patienten in dieser Studie auch an einer chronischen Erkrankung litt, kann zumindest teilweise auf das zunehmende Bewusstsein für die Rolle des EMs bei diesen Krankheitsbildern zurückgeführt werden. Interessanterweise zeigten die meisten Patienten in dieser Studie leere Eisenspeicher.
Diagnose von EM/EMA
Wie im neuesten Delphi Konsens3 empfohlen, werden bei mehr als 80 % der Patienten Hb, Ferritin, MCV und MCHC untersucht. In dieser Erhebung bestimmten lediglich 2 % bzw. 7 % der Hausärzte den MCV- und MCHC-Wert nicht. Die Bestimmung von MCV und MCHC wird im Konsens3 ebenfalls empfohlen, da sie bei der Abgrenzung der EMA gegenüber entzündlicher Anämie oder einer Kombination beider Formen hilfreich sein können. Diese Resultate zeigen, dass eine Sensibilisierung der Hausärzte für die Interpretation hämatologischer Parameter weiterhin wichtig ist.
Obwohl uns dieser Bericht nicht erlaubte, eine detaillierte Analyse für jeden einzelnen Patienten durchzuführen, wurden die Grenzwerte der Laborparameter (d.h. Hb und Ferritin) weitgehend eingehalten, wie in den Leitlinien und dem Expertenkonsensus empfohlen. Da die Ferritin-Medianwerte bei der Mehrheit der Patienten mit chronisch-entzündlichen Erkrankungen niedrig sind (z. B.: HF, Ferritin: 25 µg/l), ist es möglich, dass die Hausärzte nicht ausreichend darüber informiert sind, dass Ferritin ein Akutphasenprotein ist. Im Gegensatz zu den Konsensempfehlungen der Experten3 bestimmen tatsächlich etwa 11 % der Hausärzte CRP und Ferritin nicht gleichzeitig. In solchen Fällen kann die TSAT hilfreich sein. Obwohl der Nutzen der TSAT auch begrenzt sein kann, weil Transferrin ein negatives Akutphasenprotein ist, wird die Bestimmung in den aktuellen Leitlinien für chronische Erkrankungen empfohlen. Wir haben im Verlauf dieser Studie gesehen, dass die TSAT nur selten gemessen wird. Bei Patienten mit chronischen Erkrankungen wie z. B. HF wird daher eine routinemäßige Kontrolle des Ferritins und der TSAT empfohlen, bevor sich eine Anämie anbahnt. Bei der zweiten Nachuntersuchung, d. h. weniger als 8 Wochen nach Beginn der Eisenbehandlung gab ein relativ hoher Prozentsatz der Hausärzte (40 %) an, dass sie den Ferritinwert bestimmten. Es ist zu beachten, dass das Ferritin wegen der Stimulation der Synthese durch die intravenöse Eisenverabreichung kurzfristig stark ansteigt und danach kontinuierlich absinkt. Ferritinmessungen für 8–12 Wochen nach intravenöser Eisensupplementierung (IVES) unzuverlässig und Ferritin korreliert unter diesen Bedingungen erst danach wieder mit dem Speichereisen. Die Interpretation der Ferritin-Serumspiegel ist im Zusammenhang mit einer Entzündung, chronischen Erkrankung, Lebererkrankungen oder kurz nach einer IV-Eisentherapie schwieriger. Der Online-Rechner von ironmedicine.ch sollte für Patienten mit chronischer Erkrankung nicht verwendet werden, da er sich auf Ferritinspiegel stützt, die aufgrund von Entzündungen weniger zuverlässig als Marker für die Eisenspeicher unter diesen Bedingungen sind. Das klinische Bild sollte in Situationen, in denen die Aussagekraft des Ferritin-Serumspiegels, z. B. aufgrund einer chronischen Entzündung beeinträchtigt ist, daher zusammen mit anderen Markern wie z. B. dem CRP oder der TSAT gründlicher berücksichtigt werden. Die neueste Produktinformation für IVES aus dem Jahr 2021 enthält nun eine neue und vereinfachte Formel, die es Hausärzten künftig erleichtern wird, den Eisenbedarf auf der Grundlage eines vereinfachten Dosierungsplans zu bestimmen.14
Behandlung von EM/EMA
Die direkte IVES-Gabe wurde am häufigsten bei Patienten mit schwerer Symptomatik verordnet, wahrscheinlich um schnell Eisen zuzuführen. Wie bereits erwähnt, wiesen die meisten Patienten in dieser Studie leere Eisenspeicher auf, was die hohe Zahl der Patienten mit IVES erklären könnte. Eine frühere Beobachtungsstudie unter 279 Hausärzten und ihren Patienten in der Schweiz berichtete über einen signifikanten Zusammenhang zwischen der Verschreibung von IVES anstelle von OES aufgrund des Schweregrads des EMs (erkennbar an den Ferritinspiegeln im Serum und dem Vorliegen einer Anämie), fortgeschrittener CKD, IBD und dem männlichen Geschlecht des Hausarztes.15
Es ist zu beachten, dass in der Schweiz eine IVES nur bei Patienten mit Eisenmangel, bei welchen eine orale Eisentherapie ungenügend wirksam, unwirksam oder nicht durchführbar ist, zugelassen ist.14 Eine orale Eisengabe kann bei den folgenden Situationen als nicht durchführbar erachtet werden: bei Unverträglichkeit oraler Eisenpräparate, bei entzündlichen Magen-Darmerkrankungen, z. B. Colitis ulcerosa, die sich durch eine orale Eisentherapie verschlimmern können, oder bei therapierefraktären Eisenmangelzuständen mit Verdacht auf unzuverlässige Einnahme oraler Eisenpräparate.14
Limitationen dieser Studie
Aufgrund der nicht-randomisierten Natur der vorliegenden Studie können Bias bei der Auswahl der erfassten Patienten durch die Hausärzte nicht ausgeschlossen werden. Die Zahl der eingeschlossenen Patienten ist relativ klein und die Varietät bei vorhandenen Komorbiditäten erschweren die Interpretation der Daten, im Besonderen die Diagnostik. Zudem beschränkt sich die Studie auf Patienten, die eine intravenöse Eisentherapie erhalten haben. Des Weiteren gab es keine Qualitätskontrolle beim Ausfüllen der Fragebögen durch die Hausärzte. Die Angaben reflektieren möglicherweise nicht die tatsächliche klinische Situation der Patienten (beispielsweise ergab die Nachverfolgung eines Pharmakovigilanz-Falls, dass der Patient an einer nicht gelisteten chronischen Erkrankung litt).
Wichtige Schlussfolgerungen für Hausärzte
-
Drei Hauptgruppen sind besonders von EM betroffen:
-
Junge Frauen (im Alter von 18–45 Jahren) und Personen, die eine spezielle Diät einhalten (z. B. Vegetarier, Veganer usw.)
-
Patienten mit chronischen Erkrankungen, einschliesslich HF, CKD und IBD
-
Ältere und betagte Patienten
-
-
Hausärzte sollten alle hämatologischen Parameter berücksichtigen für eine Diagnose des EMs/der EMA. Andernfalls besteht die Gefahr, dass Patienten, die an EM leiden, übersehen werden und nicht behandelt oder überbehandelt werden. Hierdurch kann eine willkürliche Anwendung von Eisenersatztherapien hervorgerufen werden.
-
Ferritin kann bei Patienten mit systemischer Inflammation oder Lebererkrankungen erhöht sein und stellt dadurch einen weniger zuverlässigen Marker für den Eisenspeicher dar. Gemäss unterschiedlicher Leitlinien kann eine geringe Transferrinsättigung (TSAT) in diesen Situationen hilfreiche Hinweise auf einen vorliegenden EM geben.
Ethische Zustimmung
Gemäss der Ethikkommission des Kantons Zürich fällt das Projekt nicht in den Geltungsbereich des Humanforschungsgesetzes, weshalb kein Ethikvotum erforderlich ist (BASEC-Nr. Req-2019-00973).
Conflict of interest
Petr Sladovnik erhielt ausschliesslich für die Daten-Analyse und -Interpretation ein Beraterhonorar.
Lukas Zimmerli erhielt ausschliesslich für die Daten-Analyse und -Interpretation ein Beraterhonorar.
Funding
Dieser Praxiserfahrungsbericht wurde von Vifor Pharma, Villars-sur-Glâne, Schweiz, unterstützt.
Acknowledgement
Die redaktionelle Unterstützung erfolgte durch H+O communications Ltd., Zürich, Schweiz.
Die statistische Auswertung wurde von Datametrix SA, Neuchâtel, Schweiz erstellt.
Wir danken Dr. Stéphane Genoud (Medical Department; Vifor Pharma, Schweiz), der mit seinem Wissen und seiner Erfahrung die Studie wesentlich unterstützt hat.