Für chronisch-entzündliche Darmerkrankungen (IBD) – insbesondere Colitis ulcerosa und Morbus Crohn – steht derzeit keine kurative medikamentöse Therapie zur Verfügung. Einzige Ausnahme bildet die chirurgische Kolektomie bei therapierefraktärer Colitis ulcerosa. Ziel der Behandlung ist deshalb die frühzeitige Induktion und anschliessende Erhaltung einer Remission, um Symptome zu kontrollieren, die entzündliche Aktivität zu reduzieren und das Risiko von Rezidiven zu minimieren. Die Pathogenese der IBD ist komplex und wird durch immunologische, genetische, mikrobielle und umweltbezogene Faktoren mitgeprägt. Entsprechend erfordert das Management der Erkrankung einen strukturierten, evidenzbasierten Therapieansatz – insbesondere bei moderater bis schwerer Aktivität.1
Management von IBD gemäss ECCO-Leitlinien
Die aktuell gültigen ECCO-Leitlinien zu Colitis ulcerosa (2022) und Morbus Crohn (2024) geben ein evidenzbasiertes Rahmenwerk für den Einsatz von Biologika und niedermolekularen Substanzen bei mittelschwerer bis schwerer IBD vor.2,3 Zentrale Elemente sind eine schweregradorientierte Therapie (mild, moderat, schwer) und die frühe Einleitung effektiver Wirkstoffe bei Patienten mit prognostisch ungünstigen Faktoren, etwa ausgedehntem Befall, tiefen Ulzerationen oder steroidrefraktärem Verlauf. Biologika oder niedermolekulare Substanzen werden bevorzugt eingesetzt, wenn ein unzureichendes Ansprechen auf konventionelle Therapien wie Aminosalicylate, Steroide oder Immunmodulatoren besteht. Die Empfehlungen folgen dem Prinzip eines Treat-to-Target-Ansatzes, bei dem steroidfreie Remission, endoskopische Heilung und Verbesserung der Lebensqualität als primäre Ziele definiert sind. Dabei betonen die Leitlinien ausdrücklich, dass ein kurzfristiger Induktionserfolg nicht ausreicht – vielmehr ist eine wirksame Erhaltungsbehandlung essenziell, um eine langfristige Krankheitskontrolle und Vermeidung von Rezidiven zu erreichen.2,3
Eine detaillierte Diskussion der Behandlungsalgorithmen erfolgt im Rahmen dieses Artikels bewusst nicht. Die Auswahl der dargestellten Wirkstoffe orientiert sich an den ECCO-Leitlinien zu Colitis ulcerosa (2022) und Morbus Crohn (2024), die zum jeweiligen Zeitpunkt empfohlene und zugelassene Wirkstoffe systematisch zusammenfassen, jedoch teilweise bereits überholt sind2,3 (ein Update der ECCO-Leitlinie zur medikamentösen Behandlung der Colitis ulcerosa befindet sich aktuell in Überarbeitung; die Publikation der aktualisierten Version ist gemäss ECCO-Fahrplan für 2025/2026 vorgesehen4; ein Update der ECCO-Leitlinie zu Morbus Crohn dürfte frühestens ab 2027/2028 erfolgen). Dieser Review berücksichtigt daher ergänzend auch Substanzen, die nach Veröffentlichung der Leitlinien für Colitis ulcerosa und/oder Morbus Crohn neu zugelassen wurden oder sich in fortgeschrittener klinischer Entwicklung befinden Ziel ist es, einen aktuellen Überblick über die zentralen Substanzgruppen zu geben – unabhängig von ihrer Positionierung in spezifischen Behandlungspfaden.
Konventionelle Therapien bei IBD
Zur medikamentösen Therapie der IBD stehen verschiedene «klassische» Substanzen mit unterschiedlichen Wirkmechanismen zur Verfügung. Hierzu zählen orale oder rektale Aminosalicylate (z. B. Mesalazin, Sulfasalazin, Olsalazin, Balsalazid), Kortikosteroide (oral, rektal oder parenteral, z. B. Budesonid, Prednison, Methylprednisolon, Dexamethason, Deflazacort, Hydrocortison) sowie Immunmodulatoren (oral oder injizierbar, z. B. Azathioprin, Methotrexat).1,5–7
Biologika und niedermolekulare Substanzen in der IBD-Therapie
Neben den erwähnten Standardtherapien wurden in den letzten Jahren zunehmend Biologika und niedermolekulare Substanzen («small molecules») zur Behandlung von Colitis ulcerosa und Morbus Crohn erforscht und entwickelt, die an verschiedenen Signalwegen ansetzen, um die zugrunde liegende Immunaktivierung gezielt zu modulieren.8 Abbildung 1 gibt einen Überblick über die Wirkmechanismen der einzelnen Biologika und small molecules, die in der Therapie der IBD eingesetzt werden.
Mehrere dieser Substanzen sind in der Schweiz für die Behandlung von Colitis ulcerosa und/oder Morbus Crohn zugelassen und werden darüber hinaus auch in weiteren zugelassenen Indikationsgebieten eingesetzt. In Tabelle 1 sind die zugelassenen Substanzen zusammengefasst.10,11
TNF-α-Inhibitoren
Die Biologika Adalimumab, Certolizumab pegol, Golimumab und Infliximab neutralisieren das proinflammatorische Zytokin Tumornekrosefaktor-α (TNF-α) und wirken dadurch entzündungshemmend. Der Effekt beruht unter anderem auf der Induktion von Apoptose in T-Zellen der Lamina propria.12 Einige TNF-α-Inhibitoren fördern zusätzlich die mukosale Heilung, indem sie die Aktivität M2-polarisierter Makrophagen steigern.12 TNF-α-Inhibitoren sind seit vielen Jahren Bestandteil der IBD-Therapie und gelten heute als etablierte Option im Behandlungsschema.13 Abhängig vom Schweregrad der Erkrankung und prognostisch ungünstigen Faktoren erfolgt ihr Einsatz zunehmend bereits in frühen Krankheitsphasen.13
Interleukin-Inhibitoren (IL-12/23- und IL-23-Inhibitoren)
Die Biologika Risankizumab, Ustekinumab, Guselkumab und Mirikizumab und binden selektiv an Untereinheiten der proinflammatorischen Interleukine, insbesondere IL-23 und/oder IL-12, und modulieren dadurch entzündliche Signalwege bei chronisch-entzündlichen Darmerkrankungen.9 Bei Morbus Crohn und Colitis ulcerosa sind in der Schweiz Risankizumab,14 Ustekinumab15 und seit Ende Mai 2025 auch Guselkumab16 zugelassen. Mirikizumab wurde im November 2023 in der Schweiz zur Therapie der Colitis ulcerosa zugelassen.17 Innerhalb der EU ist Mirikizumab auch bereits für die Behandlung von Morbus Crohn indiziert,18 während die Zulassung der Indikation in der Schweiz derzeit noch aussteht.17
In den Phase-III-Studien INSPIRE und COMMAND bewies Risankizumab seine signifikante Überlegenheit gegenüber Placebo bei der Behandlung von Patienten mit moderater bis schwerer aktiver Colitis ulcerosa.19 Auch bei mittelschwerem bis schwerem aktivem Morbus Crohn war der IL-23-Inhibitor in den beiden 12-wöchigen Phase-III-Induktionsstudien ADVANCE und MOTIVATE wirksam und gut verträglich.20 Die langfristige Wirksamkeit von Risankizumab bei Morbus Crohn wurde in der 52-wöchigen, randomisierten, placebokontrollierten Phase-III-Erhaltungsstudie FORTIFY belegt: Ein signifikanter Anteil der Patienten erreichte eine klinische und endoskopische Remission; zudem war das Sicherheitsprofil konsistent. Die untersuchte Population bestand aus Patienten, die in den Induktionsstudien (ADVANCE und MOTIVATE) ein klinisches Ansprechen gezeigt hatten. Ergebnisse aus responderbasierten Studienabschnitten sind im Hinblick auf das Gesamtansprechen der ursprünglichen Studienkohorte entsprechend differenziert zu interpretieren.21
In der Phase-IIIb-Studie SEQUENCE wurde Risankizumab über 48 Wochen direkt mit Ustekinumab verglichen. Dabei war es hinsichtlich der klinischen Remission nach 24 Wochen nicht unterlegen und erzielte nach 48 Wochen signifikant höhere Raten endoskopischer Remission.22
Die Wirksamkeit und Sicherheit von Ustekinumab bei Patienten mit moderater bis schwerer aktiver Colitis ulcerosa wurden in der Phase-III-Studie UNIFI nachgewiesen, die aus einer 8-wöchigen Induktions- und einer 44-wöchigen Erhaltungsphase bestand.23 Auch bei Morbus Crohn führte Ustekinumab zu signifikanten Verbesserungen, wie in den beiden 8-wöchigen Phase-III-Induktionsstudien UNITI-1 und UNITI-2 sowie der 44-wöchigen Erhaltungsstudie IM-UNITI gezeigt wurde.24
Guselkumab zeigte in den Phase-III-Studien GALAXI 2 und 3 in allen endoskopischen Endpunkten eine bessere Wirksamkeit als Ustekinumab bei Patienten mit mittelschwerem bis schwerem Morbus Crohn.25 In der Phase-III-Studie GRAVITI wurde zusätzlich eine rein subkutane Gabe von Guselkumab über 12 Wochen Induktion und 48 Wochen Erhaltung untersucht. In Woche 48 lag die klinische Remission bei 60,0–66,1% und das endoskopische Ansprechen bei 44,3–51,3%, verglichen mit 17,1% bzw. 6,8% unter Placebo (p<0,001). Beide primären Endpunkte (CDAI-Remission und endoskopisches Ansprechen) wurden erreicht. Sowohl GALAXI 2&3 als auch GRAVITI waren als treat-through-Studien konzipiert, bei denen alle randomisierten Patient:innen (ITT-Kohorte) über Induktion und Erhaltung evaluiert wurden.26,27
Die Wirksamkeit und Sicherheit von Guselkumab bei Patienten mit moderater bis schwerer aktiver Colitis ulcerosa wurde im placebokontrollierten Phase-III-Studienprogramm QUASAR nachgewiesen. In Woche 12 erreichten 23% der Patienten unter Guselkumab eine klinische Remission, verglichen mit 8% unter Placebo (p<0,0001). In der Erhaltungsphase (Woche 44) lag die Remissionsrate bei 50% unter 200 mg alle 4 Wochen, bei 45% unter 100 mg alle 8 Wochen und bei 19% unter Placebo (p<0,0001).28
Mirikizumab, ein selektiver IL-23-Inhibitor, bewies in der randomisierten Phase-III-Studienreihe LUCENT (LUCENT-1 bis -3) seine signifikante Wirksamkeit bei Patienten mit moderater bis schwerer aktiver Colitis ulcerosa.29,30 In den Phase-III-Studien wurde unter dem IL-23-Hemmer sowohl die Induktion einer Remission (LUCENT I) als auch der Remissionserhalt (LUCENT II) im Vergleich zu Placebo signifikant verbessert. In der 12-wöchigen Induktionsstudie LUCENT-1 erreichten 24,2% der Patienten unter Mirikizumab eine klinische Remission, verglichen mit 13,3% in der Placebogruppe (p<0,001).20
In der anschliessenden Erhaltungsstudie LUCENT-2 wurde bei 49,9% der Patienten unter Mirikizumab eine Remission über 40 Wochen aufrechterhalten, während dies unter Placebo nur bei 25,1% der Patienten gelang (p<0,001).30 Zu berücksichtigen ist, dass in LUCENT-2 ausschliesslich Patienten mit einem klinischen Ansprechen auf die Induktionstherapie weiterbehandelt wurden. Die berichteten Remissionsraten beziehen sich somit auf eine präselektierte Responderkohorte und sind nicht direkt auf alle ursprünglich randomisierten Studienteilnehmer (Intention-to-Treat-Population) übertragbar.30
Die laufende offene Verlängerungsstudie LUCENT-3 untersuchte die langfristige Wirksamkeit und Sicherheit einer kontinuierlichen Mirikizumab-Therapie über bis zu 152 Wochen bei Patienten mit moderat bis schwerer aktiver Colitis ulcerosa. Nach zwei Jahren (104 Wochen) befanden sich über 70% der Patienten, die initial auf die Induktionstherapie angesprochen hatten, in klinischer Remission, unabhängig davon, ob zuvor ein Therapieversagen mit biologischen Arzneimitteln vorlag.31
Integrin-Antagonisten
Vedolizumab und Natalizumab sind humanisierte monoklonale Antikörper, die spezifisch an Integrine auf Gedächtnis-T-Lymphozyten binden. Durch Blockade der Interaktion mit endothelialen Liganden verhindern sie die Adhäsion dieser Zellen an das Darmendothel und hemmen so deren Migration durch das vaskuläre Endothel in das entzündete Gewebe.32 Während Vedolizumab in der Schweiz zur Therapie von Colitis ulcerosa und Morbus Crohn zugelassen ist, hat Natalizumab diese Zulassung aktuell nicht, ist aber zur Behandlung der Multiplen Sklerose indiziert. Der Einsatz von Natalizumab ist mit einem signifikanten Risiko für die Entwicklung einer progressiven multifokalen Leukenzephalopathie (PML) verbunden – einer seltenen, z. T. tödlichen opportunistischen ZNS-Infektion.33,34
Die langfristige Wirksamkeit von Vedolizumab bei IBD wurde in der offenen Phase-IIIb-Studie VISIBLE-OLE untersucht.35 Eingeschlossen waren Patienten mit Colitis ulcerosa oder Morbus Crohn, die zuvor an den Studien VISIBLE 1 (CU) oder VISIBLE 2 (MC) teilgenommen hatten. Dazu zählten sowohl randomisierte Completer nach Abschluss der 52-wöchigen Erhaltungsphase als auch nicht-randomisierte Responder, die nach der dritten Vedolizumab-Infusion (Woche 6) in Woche 14 auf die Behandlung angesprochen hatten. Alle Studienteilnehmer erhielten eine sub-kutane Erhaltungstherapie mit Vedolizumab (108 mg alle zwei Wochen). Die analysierte Population stellt damit eine therapeutisch selektierte Gruppe dar; die berichteten Remissionsraten erlauben Aussagen zur Langzeitwirksamkeit bei initialem Ansprechen, sind jedoch nicht direkt auf die ursprüngliche Studienpopulation übertragbar. Bei CU-Patienten lagen die klinischen Remissionsraten zu Studienbeginn – abhängig von der Vorbehandlung – bei 55,0% (Placebo), 91,3% (subkutan) und 77,1% (intra-venös) und sanken bis Woche 168 auf 40,0%, 56,5% bzw. 62,9%.35 Bei den nicht-randomisierten CU-Respondern (n=107) fiel die Remissionsrate von 57,0% auf 29,9%.
Bei den Patienten mit MC (n=231) lagen die Remissionsraten zu Studienbeginn – abhängig von der Vorbehandlung in VISIBLE 1 – bei 55,0% (Placebo), 91,3% (subkutanes Vedolizumab) bzw. 77,1% (intravenöses Vedolizumab). Nach 168 Wochen zeigte die Studie entsprechende Raten von 40,0%, 56,5% bzw. 62,9%.35
Auch bei MC-Patienten blieben die Effekte über drei Jahre erhalten: Bei randomisierten Completern (n=226) lagen die Remissionsraten je nach Vorbehandlung bei 60,3% (Placebo) bzw. 62,0% (subkutan) und reduzierten sich bis Woche 168 auf 32,4% bzw. 37,3%. Bei nicht-randomisierten Respondern mit MC (n=118) fiel die Remissionsrate von 57,6% auf 27,1%. Insgesamt bestätigten die Daten eine anhaltende klinische Wirksamkeit von Vedolizumab über mehr als drei Jahre bei beiden Entitäten. Das Sicherheitsprofil blieb über den gesamten Beobachtungszeitraum stabil; neue Sicherheitssignale traten nicht auf, abgesehen von vereinzelten lokalen Reaktionen an der Injektionsstelle.35
Januskinase-Inhibitoren
Die niedermolekularen Substanzen Filgotinib, Tofacitinib und Upadacitinib wirken als Inhibitoren der Januskinasen (JAKs). Dabei handelt es sich um intrazelluläre Enzyme, die zur Gruppe der Tyrosinkinasen gehören und Phosphatgruppen übertragen, wobei mit JAK1, JAK2, JAK3 und TYK2 vier Mitglieder der JAK-Familie unterschieden werden, die je nach eingesetztem JAK-Inhibitor selektiv gehemmt werden.36 Die Januskinasen sind an der Signalweiterleitung von der Zellmembran zum Zellkern beteiligt und beeinflussen so die Genexpression. Wird dieser JAK-STAT-Signalweg gehemmt, können die Signale proinflammatorischer Zytokine nicht mehr weitergeleitet werden, was letztlich dazu führt, dass die Entzündung abklingt. JAK-Inhibitoren haben somit entzündungshemmende sowie immunsuppressive und antiproliferative Eigenschaften. In der Schweiz sind die beiden JAK-Inhibitoren Tofacitinib und Upadacitinib zur Behandlung chronisch-entzündlicher Darmerkrankungen zugelassen.10,11
In der Phase-III-Studie U-ACHIEVE konnten Patienten mit mittelschwerer bis schwerer aktiver Colitis ulcerosa von einer langfristigen Erhaltungstherapie mit Upadacitinib profitieren.37 So wurde nach 52 Wochen unter dem JAK-Inhibitor signifikant häufiger eine klinische Remission erreicht als unter Placebo (40,4% unter 15 mg bzw. 53,6% unter 30 mg vs 10,8% unter Placebo; p<0,0001).
Tofacitinib, der erste in der Schweiz zur Therapie der UC zugelassene JAK-Inhibitor, konnte ebenfalls seine langfristige Wirksamkeit und Sicherheit in OCTAVE Open unter Beweis stellen.38 In der Verlängerungsstudie erhielten 175 Patienten mit moderater bis schwerer CU, die zuvor in den Induktionsstudien OCTAVE Induction 1 und 2 sowie in der Erhaltungsstudie OCTAVE Sustain eine Remission erreicht hatten, zweimal täglich 5 mg Tofacitinib, die übrigen 769 Patienten, die nicht in Remission waren, wurden mit zweimal täglich 10 mg Tofacitinib behandelt. In Monat 36 sprachen 66,9% bzw. 40,3% klinisch auf die Therapie an, bei 64,6% bzw. 37,1% waren endoskopische Verbesserungen nachweisbar und 58,9% bzw. 33,7% hielten die Remission aufrecht oder erreichten eine Remission. Dabei wurden die Patienten über einen Zeitraum von bis zu sieben Jahren beobachtet, wobei Tofacitinib ein konsistentes, dem bisherigen Profil entsprechendes Sicherheitsprofil aufwies.38
Die Daten der Phase-III-Erhaltungsstudie U-ENDURE belegen, dass Upadacitinib auch bei Patienten mit moderatem bis schwerem aktivem Morbus Crohn langfristig einen Vorteil gegenüber Placebo aufweist.39 So hatte in Woche 52 ein höherer Prozentsatz der Patienten eine klinische Remission unter einer Therapie mit 15 mg Upadacitinib (37,3%) bzw. mit 30 mg Upadacitinib (47,6%) als unter Placebo (15,1%; p<0,001). Zudem erreichten unter 15 mg Upadacitinib 27,6% und unter 30 mg Upadacitinib 40,1% ein endoskopisches Ansprechen im Vergleich zu 7,3% unter Placebo (jeweils p<0,001). Auch hier basieren die Remissionsdaten auf einer Population, die in der Induktion (U-EXCEL oder U-EXCEED) ein Ansprechen zeigte.39
S1P-Rezeptormodulatoren
Die niedermolekularen S1P-Rezeptormodulatoren Ozanimod, Etrasimod und Amiselimod binden an Sphingosin-1-Phosphat-(S1P)-Rezeptoren in lymphatischen Geweben. Diese Rezeptoren regulieren u. a. die Angiogenese, Gefässpermeabilität und den Transport von T- und B-Zellen.40 Durch Modulation der Rezeptoren wird die Auswanderung von T-Lymphozyten aus lymphatischen Organen gehemmt, was zu einer Reduktion zirkulierender Lymphozyten und damit zu einer Abschwächung der intestinalen Entzündung führt. In der Schweiz sind derzeit Ozanimod und Etrasimod zur Behandlung der Colitis ulcerosa zugelassen.10
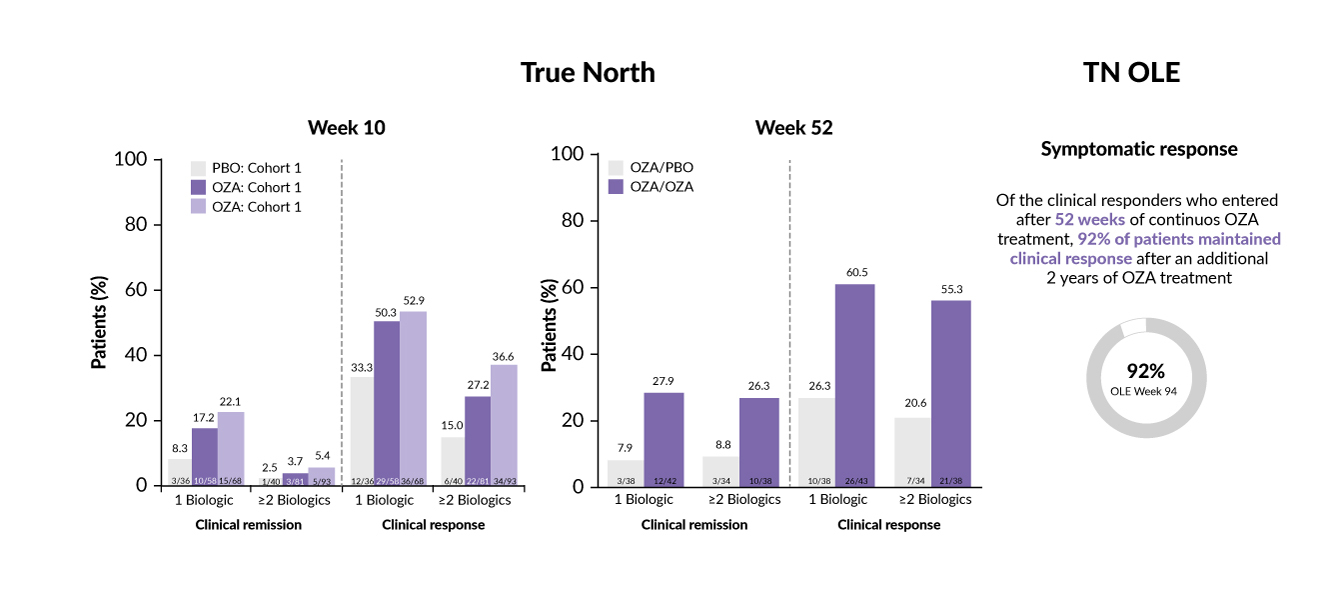
Die Zulassung von Ozanimod basiert auf den Ergebnissen der randomisierten Phase-III-Studie True North sowie ihrer offenen Verlängerungsstudie True North OLE.41 In der 10-wöchigen Induktionsphase der True-North-Studie wurden insgesamt 376 Patienten mit moderater bis schwerer aktiver Colitis ulcerosa im Verhältnis 2:2:1 randomisiert und erhielten Ozanimod (0,93 mg einmal täglich oral) entweder doppelblind (Kohorte 1), offen (Kohorte 2) oder Placebo. In der anschliessenden 42-wöchigen Erhaltungsphase wurden 72 vormals auf Ozanimod ansprechende Patienten auf Placebo umgestellt, während 81 weiterhin mit Ozanimod behandelt wurden. In der offenen Verlängerungsstudie True North OLE erfolgte bei ausgewählten Patienten eine kontinuierliche Therapie mit Ozanimod über weitere 94 Wochen.41
Der primäre Endpunkt der True-North-Studie war die klinische Remission, definiert über die Ausprägung rektaler Blutungen, die Stuhlfrequenz sowie endoskopische Befunde. Ein zentraler sekundärer Endpunkt war das klinische Ansprechen, gemessen anhand der Veränderung des 9-Punkte-Mayo-Scores. Die wichtigsten Ergebnisse sind in Abbildung 2 dargestellt.41
Die Behandlung mit Ozanimod führte zu signifikant verbesserten Remissions- und Ansprechraten nach 10 sowie insbesondere nach 52 Wochen – auch bei Patienten, die zuvor mit zwei oder mehr Biologika vorbehandelt worden waren. Die Wirksamkeit blieb auch im Verlauf einer kontinuierlichen Therapie über insgesamt drei Jahre bestehen. Während des gesamten Beobachtungszeitraums traten keine neuen sicherheitsrelevanten Signale auf.41
Ozanimod ist ein oral applizierbarer, selektiver Modulator der S1P₁- und S1P₅-Rezeptoren. Durch Bindung an diese Rezeptorsubtypen wird die Auswanderung von Lymphozyten aus sekundären lymphatischen Organen gehemmt, wodurch die Zahl zirkulierender Immunzellen reduziert und die entzündliche Aktivität im Darm abgeschwächt wird.
In der randomisierten Phase-III-Studie True North und ihrer offenen Verlängerungs-studie True North OLE führte Ozanimod zu signifikanten Verbesserungen bei Patienten mit moderater bis schwerer aktiver Colitis ulcerosa – auch bei vorausgegangenem Therapieversagen mit zwei oder mehr Biologika. Remissions- und Ansprechraten verbesserten sich nach 10 und insbesondere nach 52 Wochen, und die klinische Wirksamkeit blieb auch über eine Behandlungsdauer von bis zu drei Jahren erhalten. Während des gesamten Studienzeitraums wurden keine neuen sicherheitsrelevanten Signale beobachtet.42 Ozanimod ist in der Schweiz zur Behandlung von Erwachsenen mit mittelschwerer bis schwerer aktiver Colitis ulcerosa zugelassen.
Etrasimod ist ein oral applizierbarer, selektiver Modulator des S1P₁-Rezeptors mit entzündungshemmender Wirkung durch Hemmung der Lymphozytenauswanderung aus lymphatischen Organen. Die Wirksamkeit und Sicherheit von Etrasimod bei Colitis ulcerosa wurden in den beiden randomisierten, placebokontrollierten Phase-III-Studien ELEVATE UC 52 und ELEVATE UC 12 untersucht.42 Insgesamt wurden 787 Erwachsene mit mittelschwerer bis schwerer aktiver Colitis ulcerosa eingeschlossen, die unzureichend auf mindestens eine zugelassene Therapie angesprochen hatten oder diese nicht vertrugen. Nach Randomisierung im Verhältnis 2:1 erhielten die Patienten 2 mg Etrasimod einmal täglich oral oder Placebo.
In ELEVATE UC 52 erreichten signifikant mehr Patienten in der Etrasimod-Gruppe eine klinische Remission als unter Placebo – sowohl nach 12 Wochen (27% vs 7%; p<0,0001) als auch nach 52 Wochen (32% vs 7%; p<0,0001). ELEVATE UC 12 zeigte nach 12 Wochen Remissionsraten von 25% unter Etrasimod gegenüber 15% unter Placebo (p=0,026). Das Nebenwirkungsprofil war in beiden Studiengruppen vergleichbar: In UC 52 berichteten 71% der Patienten unter Etrasimod und 56% unter Placebo über Nebenwirkungen; in UC 12 lagen die entsprechenden Raten jeweils bei 47%. In beiden Phase-III-Studien (ELEVATE UC 52 und UC 12) wurden alle randomisierten Patienten unabhängig vom späteren Ansprechen in die Wirksamkeitsanalyse einbezogen (Intention-to-Treat-Analyse). Die angegebenen Remissionsraten zu Etrasimod nach 12 bzw. 52 Wochen beziehen sich somit auf die gesamte Studienpopulation und erlauben eine realistische Einschätzung des Therapieeffekts im klinischen Gesamtkollektiv.42
Zugelassene Wirkstoffe bei IBD: Fazit und ein Sicherheitsaspekt
TNF-α-Inhibitoren und auch der Integrinantagonist Vedolizumab sind seit einigen Jahren fester Bestandteil der IBD-Therapie. Aktuelle IL-23-Hemmer stellen eine vielversprechende Option insbesondere bei refraktären Patienten dar. Auch JAK-Inhibitoren führen zu signifikanten Verbesserungen bei mittelschwerer bis schwerer aktiven IBD, ebenso wie die vor kurzem bei Colitis ulcerosa zugelassenen S1P-Rezeptormodulatoren – vor allem bei Patienten mit unzureichendem Therapieansprechen unter Biologika.
Allerdings muss berücksichtigt werden, dass unter der Therapie mit JAK-Inhibitoren das Risiko für Malignome, schwerwiegende kardiovaskuläre Ereignisse, schwere Infektionen, Thrombosen und Gesamtmortalität erhöht ist. Daher sollten laut EMA Patienten, die älter als 65 Jahre sind, rauchen oder früher geraucht haben oder andere Risikofaktoren für maligne bzw. kardiovaskuläre Erkrankungen aufweisen, nur dann mit JAK-Inhibitoren behandelt werden, wenn keine geeigneten Behandlungsalternativen zur Verfügung stehen.43,44
Neue Wirkstoffe und Indikationserweiterungen in der klinischen Entwicklung
Neben den bereits zugelassenen Biologika und niedermolekularen Substanzen zur Therapie von Colitis ulcerosa und Morbus Crohn befinden sich derzeit eine Vielzahl neuer Wirkstoffe sowie Indikationserweiterungen bestehender Therapien in klinischer Prüfung. Dabei werden auch Substanzen aus Wirkstoffklassen evaluiert, die bisher noch nicht bei der Behandlung von IBDs eingesetzt wurden. Hierzu zählen beispielsweise Anti-TL1A-Antikörper wie RO7790121, Tulisokibart und Duvakitug, die an das proinflammatorische Zytokin TL1A binden und dessen Interaktion mit dem Death-Rezeptor 3 (DR3) blockieren. Dadurch wird die nachgeschaltete Aktivierung inflammatorischer Signalwege in verschiedenen Immunzelltypen unterdrückt.8
Ein weiteres Wirkprinzip verfolgt der miR-124-Modulator Obefazimod, der selektiv die Expression der antiinflammatorischen microRNA 124 (miR-124) steigert. Dies führt zur Reduktion proinflammatorischer Zytokinproduktion, die eine zentrale Rolle bei intestinalen Entzündungsprozessen spielt.45 NLRX1-Agonisten wie Amelenodor aktivieren gezielt das regulatorische Protein NLRX1 im Darmepithel, welches immunmodulierende Funktionen ausübt.46 Darüber hinaus werden RIPK1-Inhibitoren wie GSK2982772 untersucht, die die Aktivität der Rezeptor-interagierenden Proteinkinase 1 (RIPK1) hemmen – ein intrazelluläres Enzym, das eine Schlüsselrolle bei der Regulation der intestinalen Entzündungsantwort einnimmt.47
Die Tabellen 2A und 2B geben eine Übersicht über die Substanzen gegen moderate bis schwere aktive chronische Darmerkrankungen, die sich derzeit in der Entwicklungsphase befinden.8
Schlussfolgerung
Die medikamentöse Therapie von Colitis ulcerosa und Morbus Crohn wurde in den letzten Jahren durch die Einführung zielgerichteter Substanzen entscheidend erweitert. Neben zugelassenen Biologika und niedermolekularen Substanzen befinden sich zahlreiche neue innovativer Wirkstoffe in der klinischen Prüfung, teils mit vielversprechenden Ergebnissen hinsichtlich Wirksamkeit und Therapiesicherheit.
Methodenkritische Initiativen wie STRIDE-II, das SPIRIT-IOIBD-Konsortium (etwa CORE-IBD zur Core Outcome Harmonisierung) sowie Empfehlungen der FDA und EMA haben in den letzten Jahren auf zentrale Limitationen traditioneller Endpunkte hingewiesen – insbesondere auf die fehlende Repräsentativität von Responder-Analysen in Erhaltungsphasen von IBD-Studien.65–71 Darauf aufbauend zeigen Retrospektivanalyse und Netzwerk-Metaanalysen wie von Barberio et al. (2025) und Kayal et al. (2023), dass Remissionsraten in selektiven Kohorten um 30–50% höher liegen als in vollständigen Intention-to-Treat-Analysen.72–75 Die Aussagekraft klinischer Studien mit Responder-basiertem Design ist für die Anwendung in der klinischen Routine nur eingeschränkt, da sie systematisch Patienten ausschliessen, die nicht auf die Induktionstherapie ansprechen.
Zeitgleich etablieren sich im Sinne eines Treat-to-Target-Ansatzes zunehmend patientenzentrierte Endpunkte – darunter steroidfreie Remission, endoskopische Heilung, Normalisierung objektiver Marker und Verbesserung der Lebensqualität. In ihrer ausführlichen Analyse betonen West et al., dass die Umsetzung dieses Konzepts in der Praxis derzeit uneinheitlich erfolgt. Entscheidende Hürden sind dabei uneinheitliche Zieldefinitionen, mangelnde Operationalisierung und unzureichende Einbindung von Real-World-Daten zur Validierung von Studienendpunkten.76
Neben methodischen Überlegungen stellt auch die zunehmende Heterogenität der IBD-Subtypen eine Herausforderung dar. Eine personalisierte Therapie – gestützt auf validierte Biomarker, molekulare Subtypen oder Therapieverläufe – wird unerlässlich, um langfristig stabile Remissionen zu erreichen. Fortschritte in der Genom-, Transkriptom-, Proteom- und Mikrobiomforschung bieten hierfür vielversprechende Ansatzpunkte. Die Verankerung dieser Erkenntnisse in der klinischen Routine erfordert jedoch klare Rahmen, kosteneffiziente Prozesse und systematische Umsetzung.8
Interessenskonflikte
Der Autor erklärt, dass das Manuskript ohne jegliche kommerzielle oder finanzielle Unterstützung verfasst wurde, die als potenzieller Interessenskonflikt ausgelegt werden könnte.
Finanzierung
Der Autor erklärt, keine finanzielle Unterstützung von einer Organisation für die eingereichte Arbeit erhalten zu haben.
Autorenbeiträge
Der Autor hat das Manuskript verfasst und es genehmigt.