Einleitung
Die Multiple Sklerose (MS) ist eine chronisch-entzündliche, demyelinisierende Autoimmunerkrankung des zentralen Nervensystems (ZNS). Sie zählt zu den häufigsten Ursachen neurologisch bedingter nicht-traumatischer Behinderungen bei jungen Erwachsenen.1,2
Während in der Schweiz 2016 rund 15’000 Patient:innen an MS erkrankt waren, sind es im Jahr 2021 bereits circa 18’000.3–5 Für diesen Anstieg scheinen verschiedene Faktoren wie die frühere Diagnosestellung der MS – bedingt durch eine höhere klinische Vigilanz, einen einfacheren Zugang zu MRI-Untersuchungen sowie die Revision der Diagnosekriterien (McDonald 2017) – aber auch demographische Faktoren wie die angestiegene Lebenserwartung der Menschen mit MS verantwortlich zu sein. Des Weiteren sind auch Veränderungen bei MS-Risikofaktoren zu berücksichtigen, da deren Prävalenz in den letzten Jahren ebenfalls zugenommen hat. Ein prominentes Beispiel hierfür ist das steigende Vorkommen von Übergewicht in der Adoleszenz.5,6
Klinisch kann sich die MS durch eine Vielzahl von Symptomen manifestieren, daruntereine Neuritis nervi optici, Paresen der Extremitäten, sensible Defizite oder Miktions- und Defäkationsstörungen. Neben diesen neurologischen Defiziten treten auch weniger sichtbare Symptome wie Fatigue, kognitive oder affektive Störungen auf.6
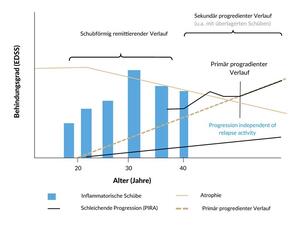
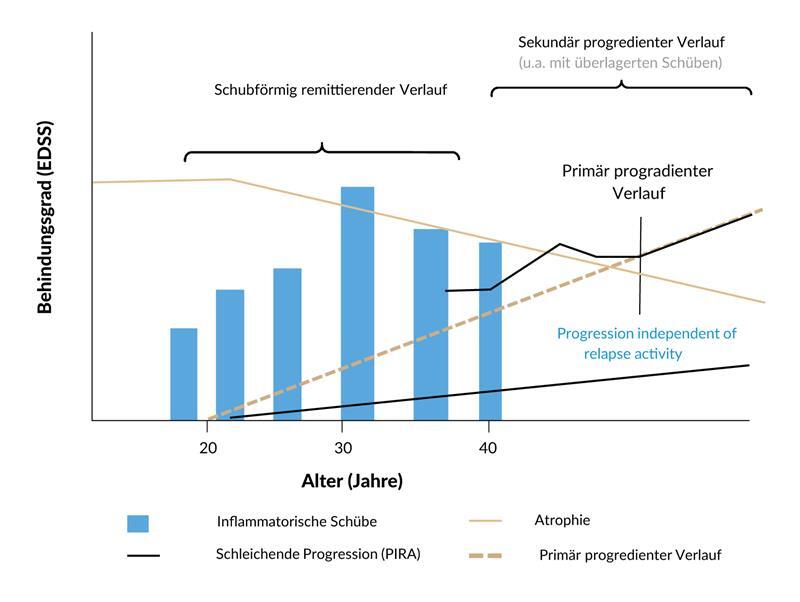
Je nach Verlauf wird die MS in drei Hauptformen unterteilt: In die schubförmig remittierende MS («relapsing remitting», RRMS), die sekundär progrediente MS (SPMS) und die primär progrediente Variante der MS (PPMS) (Abbildung 1).7 Die RRMS zeichnet sich durch akute Schübe aus, welche mindesten 24 Stunden anhalten und nicht durch andere Symptome erklärbar sind.8
Neben der Diskussion um eine bereits früh im Erkrankungsverlauf vorliegende schubunabhängige Progression (PIRA) konvertiert die RRMS bei den meisten Patient:innen im Laufe der Zeit in eine sekundär progrediente Verlaufsform (SPMS).10 Dieser Verlauf ist heterogen und weist Phasen der Progression mit möglicher Überlagerung durch Schübe sowie Perioden relativer Stabilität auf. Etwa 10 bis 20% der Patient:innen weisen eine PPMS bereits von Beginn der MS-Erkrankung an auf, die durch das Fehlen einer initialen schubförmigen Phase charakterisiert ist.10,11 Bei diesen zeigt sich über den ganzen Erkrankungsverlauf eine kontinuierliche Progression, die ebenfalls durch intermittierende Phasen relativer Stabilität unterbrochen werden kann. Frauen haben ein 2- bis 3-fach höheres Risiko als Männer, an einer RRMS zu erkranken, während diese ausgeprägte Geschlechterdifferenz bei PPMS Patient:innen nicht beobachtet wird.12
Neben diesen Verlaufsformen existiert das radiologisch isolierte Syndrom (RIS), das durch MS-typische Veränderungen in der Magnetresonanztomographie (MRT) ohne nachweisbare klinische Symptomatik definiert ist.11 Häufig wird ein RIS zufällig im Rahmen einer MRT-Untersuchung entdeckt, welche wegen einer anderen Fragestellung durchgeführt wird (z.B. nach einem Schädel-Hirn-Trauma (SHT) oder zur Abklärung von Kopfschmerzen). Neuere Erkenntnisse deuten darauf hin, dass Patient:innen mit einem RIS nicht asymptomatisch sind, sondern dass bei diesen gehäuft Beschwerden beschrieben oder beobachtet werden, welche im MS-Prodrom auftreten wie zum Beispiel eine Depression, Schmerzsyndrome oder das Reizdarmsyndrom.13
In der doppelblind randomisierten Therapiestudie «TERIS», an der auch die neuroimmunologische Studienambulanz des Zentrums der Autor:innen dieser Arbeit teilgenommen hat, konnte gezeigt werden, dass eine Behandlung mit Teriflunomid zu einer signifikanten Verlängerung der Zeit bis zum ersten klinischen Schub und somit bis zur Diagnosestellung einer MS führt.14 Eine im Ausmass vergleichbare Risikoreduktion konnte auch in einer weiteren RISTherapiestudie («ARISE») aufgezeigt werden, in der Dimethylfumarat mit Placebo verglichen wurde.15 In den Augen der Autor:innen ist weitere Forschung insbesondere zu den Effekten einer therapeutischen Modifikation der bekannten Risikofaktoren einer MS – Adipositas, Rauchen oder Vitamin-D-Mangel etc. – dringend notwendig, um zukünftig eine rationale Intervention in dieser MS-Risikogruppe anbieten zu können.
Pathogenese und Risikofaktoren
Die Ätiologie der MS ist bis heute nicht vollständig geklärt, und die diskutierten, an der Entstehung beteiligten Faktoren sind vielfältig (s. Tabelle 1). Es wird angenommen, dass die Erkrankung durch ein komplexes Zusammenspiel genetischer Prädispositionen sowie Umwelt- und Lebensstilfaktoren entsteht. Genetische Studien zeigen, dass Träger bestimmter HLA-Allele, insbesondere HLA-DRB1*15:01, ein erhöhtes Risiko für die Entwicklung einer MS aufweisen.16 Allerdings kann die genetische Prädisposition allein die Erkrankung nicht erklären, und die Konkordanzrate bei eineiigen Zwillingen liegt lediglich bei etwa 30%.16
Zu den wichtigsten Umweltfaktoren gehört die Infektion mit dem Epstein-Barr-Virus (EBV), das als potenzieller Trigger der autoimmunen Kaskade diskutiert wird.16 Eine gross angelegte Kohortenstudie konnte zeigen, dass eine symptomatische EBV-Infektion das MS-Risiko um das 32-fache erhöht.17 Es wird vermutet, dass EBV eine anhaltende Aktivierung autoreaktiver B-Zellen fördert, die im ZNS persistieren und dort eine chronische Entzündungsreaktion unterhalten.
Ein weiterer relevanter Umweltfaktor ist der Vitamin-D-Mangel. Es gibt einen Zusammenhang zwischen der geografischen Breite und der Häufigkeit von MS: In Regionen weiter vom Äquator tritt MS häufiger auf. Ein möglicher Grund dafür ist die abnehmende Sonnenlichtsexposition und die damit verbundene reduzierte Vitamin-D-Synthese, die zur Krankheitsentstehung beitragen könnten.18,19 Zudem weisen Studien darauf hin, dass Patient:innen bereits vor der Diagnose einer Multiplen Sklerose signifikant niedrigere Vitamin-D-Spiegel haben als gesunde Kontrollpersonen.20
Vitamin D hat eine immunregulatorische Wirkung, indem es die Differenzierung proinflammatorischer Th17-Zellen hemmt und die Funktion regulatorischer T-Zellen (Tregs) unterstützt.21,22 Ein Mangel an Vitamin D könnte daher die autoreaktive Immunantwort begünstigen und zur Dysregulation des Immunsystems beitragen. Eine Überdosierung kann aber auch neben anderen Nebenwirkungen mit einer Krankheitsaktivierung einhergehen, wie tierexperimentelle Studien zeigen konnten. Dies liegt vermutlich an einer Enthemmung eben dieser oben diskutierten autoreaktiven T-Zellen durch eine Hyperkalziämie.23
Immunmechanismen der MS
Bei der RRMS stehen pathophysiologisch perivenöse lymphozytäre Infiltrate des ZNS im Vordergrund, die eine akute Demyelinisierung mit konsekutiver axonaler Schädigung verursachen. Histopathologisch zeigen sich T-Zell-dominierte Entzündungsherde, unterstützt durch aktivierte B-Zellen und Mikroglia. Diese fokalen Läsionen sind MRT-morphologisch durch Gadolinium-anreichernde Kontrastmittelaufnahmen sichtbar, die eine Blut-Hirn-Schranken-Dysfunktion anzeigen. Die Remission nach einem Schub ist häufig unvollständig und wird durch Remyelinisierungsprozesse und synaptische Plastizität beeinflusst.16,24
Im Übergang von einer RRMS zu einer SPMS kommt es zu einer zunehmenden chronischen, schwelenden Inflammation, welche sich klinisch durch eine schleichende Verschlechterung und radiologisch im «klassischen Fall» durch ein langsames Läsionswachstum auszeichnet.25
Die MRT-Diagnostik zeigt in dieser Phase eine Zunahme kortikaler Läsionen und schleichend expandierender chronischer Läsionen (slowly expanding lesions), in der weissen Substanz teilweise begleitet von einem paramagnetischen Ring am Läsionsrand, welcher die Phagozytose von eisenhaltigen Erythrozyten als MRI-Korrelat darstellt. Die Pathogenese der progredienten MS vereint chronisch aktive Mikroglia-vermittelte Entzündungen mit akuten Entzündungsreaktionen, wodurch sowohl entzündliche als auch degenerative Prozesse die Krankheitsprogression vorantreiben. MRT-morphologisch können sich sowohl chronisch expandierende Läsionen sowie auch Gadolinium-anreichernde Herde zeigen.26,27
Therapeutisch erfordert diese Verlaufsform eine individualisierte Kombination, um sowohl die entzündliche als auch die degenerative Krankheitskomponente, letztere leider weiterhin eher schlecht zu behandeln, zu adressieren. Die Verlaufsformen der MS sind eng mit den zugrundeliegenden Entzündungsmustern verknüpft. Während in der frühen Phase eine T- und B-Zell-vermittelte Schubaktivität dominiert, nehmen in späteren Stadien chronisch aktive Mikroglia-, aber eben auch meningeale B-Zell-Aggregate eine zentrale Rolle ein. Diese pathophysiologischen Unterschiede erklären die heterogene Therapieantwort der verschiedenen MS-Subtypen und skizzieren die Herausforderungen, welchen wir weiterhin bei der Behandlung der Erkrankung ausgesetzt sind.
Diagnostik der Multiplen Sklerose
In den Augen der Autor:innen bleibt die Diagnosestellung der MS eine Herausforderung, insbesondere wenn die Diagnose schnell gestellt werden soll, um früh mit einer Therapie beginnen zu dürfen.
Aktuell wird die Diagnose einer MS «noch» anhand der revidierten McDonald-Kriterien von 2017 gestellt. Hierfür ist eine Kombination aus klinischen Befunden, bildgebenden Verfahren und Laboranalysen erforderlich.6 Doch in naher Zukunft werden wir, wie bereits im Rahmen des ECTRIMS-Jahreskongresses von 2024 in Kopenhagen angekündigt, eine erneute Revision der Diagnosekriterien von 2017 erwarten.28 Dabei sollen auch bildgebende Marker (u. a. zentrales Venenzeichen, paramagnetische Randläsion) sowie Labormarker (Kappa-Leichtketten Index) implementiert werden, was zu einer schnelleren Diagnosestellung der MS führen soll.29
Die frühe Diagnosestellung ist entscheidend, um rasch eine effektive Therapie einzuleiten, die das Fortschreiten der Erkrankung verlangsamt und die Lebensqualität der Patient:innen langfristig erhält.
Biomarker in der MS-Diagnostik
Die Suche nach verlässlichen Biomarkern zur frühzeitigen Erkennung und Prognoseeinschätzung der MS ist ein zentrales Thema der Forschung. Der am häufigsten verwendete Labortest ist der Nachweis oligoklonaler IgG-Banden (IgG-OKB) im Liquor, der in den revidierten McDonald-Kriterien 2017 als Proxy der Dissemination in der Zeit, sprich der chronischen Entzündungsaktivität, aufgenommen wurde.6,30 Ergänzend dazu werden bereits IgM-Indizes und insbesondere freie Leichtketten vom Typ Kappa zur Unterstützung der Diagnose und Prognosestratifikation eingesetzt.31
Die leichte Kette des Serum-Neurofilaments (sNfL) ist ein vielversprechender Biomarker zur Überwachung der Krankheitsaktivität und des Krankheitsverlaufs der MS. Sie spiegelt neuronale Schädigungen wider und wird zunehmend zur Beurteilung der Krankheitsdynamik und des Ansprechens auf die Behandlung eingesetzt.32–34 Daneben gibt es das sogenannte saure Gliafaserprotein (GFAP), welches als wichtiger Biomarker der MS insbesondere zur Bewertung der Progression diskutiert wird. Im Detail werden erhöhte Serum-GFAP-Spiegel mit einem erhöhten Schweregrad und schweren Verlauf der MS Erkrankung in Verbindung gebracht, insbesondere bei progressiven Formen der Erkrankung wie der PPMS und der sekundär progredienten MS (SPMS).34–37 GFAP-Spiegel korrelieren sowohl mit dem Expanded Disability Status Scale (EDSS) Score sowie auch mit der Anzahl der MRT-Läsionen, was auf ihr Potenzial als Erkrankungsaktivitätsmarker hinweist.35–38
Neuere Studien zeigen, dass erhöhte sNfL-Spiegel mit einer stärkeren inflammationsgetriebenen Krankheitsprogression assoziiert sind, während hohe GFAP-Werte auf eine schubunabhängige, neurodegenerative Krankheitsprogression hindeuten.34 Patienten mit erhöhtem sNfL profitieren häufiger von hochwirksamen krankheitsmodifizierenden Therapien (DMTs), während für Patienten mit primär neurodegenerativem Verlauf neue Therapieansätze erforderlich sein könnten.34 Ob diese blutbasierten Parameter auch zur Unterstützung einer De-Eskalationsstrategie, sprich einem therapeutischen Rückzug, eingesetzt werden können, muss derzeit offen bleiben.
Bildgebung mittels Hochfeld-MRT und Ultrahochfeld-MRT in der MS-Diagnostik
Die revidierten McDonald-Kriterien von 2017 setzen eine räumliche (DIS) und zeitliche Dissemination (DIT) der Erkrankung sowie den Ausschluss alternativer Diagnosen insbesondere infektiologischer, rheumatologischer oder vaskulärer Genesen voraus.6,30
Diese Kriterien ermöglichen eine frühzeitige Diagnosestellung und Therapieeinleitung.6 Dennoch besteht weiterhin das Risiko von Fehldiagnosen, was insbesondere in den ersten Jahren nach Diagnosestellung eine erhöhte Vigilanz notwendig macht. In der Meinung der Autor:innen besteht weiterführend ein dringender Bedarf an spezifischeren, klinisch relevanten MRT-Markern zur Optimierung der diagnostischen Präzision.
Die 3-Tesla-Magnetresonanztomographie (3-T MRT) ist derzeit der Standard des Inselspitals in Bern in der bildgebenden MS-Diagnostik. Sie ermöglicht die Visualisierung charakteristischer Läsionen insbesondere an den Prädilektionsstellen für eine MS (juxtakortikal, paraventrikulär, infratentoriell oder spinal) und der Beurteilung der Krankheitsaktivität. Hochfeld-MRT-Techniken, d.h. 3T-MRTs, verbessern nicht nur die morphologische Visualisierung, sondern ermöglichen auch die Identifizierung spezifischer Marker, die für den differenzialdiagnostischen Prozess und ein besseres Verständnis der Krankheitsmechanismen genutzt werden können.
Zu den wichtigsten Fortschritten zählen:
Suszeptibilitätsgewichtete Bildgebung (SWI) und quantitatives Suszeptibilitätsmapping (QSM): Diese Techniken nutzen Unterschiede in der magnetischen Suszeptibilität von Geweben und erleichtern die Darstellung von venösen Strukturen oder Eisenablagerungen, die mit chronischen Entzündungsprozessen der MS assoziiert sind. QSM erlaubt dabei die quantitative Bewertung im Vergleich zur SWI.39
a) Zentrales Venenzeichen (Central Vein Sign, CVS): MS-Läsionen zeigen häufig eine perivenöse Anordnung. Dies kann als Marker zur Unterscheidung von MS-typischen Läsionen gegenüber anderen entzündlichen Erkrankungen sowie vaskulären Veränderungen dienen (s. Abbildung 2).40–42
b) Paramagnetische Ringläsion (PRLs): Chronisch aktive MS-Läsionen können von eisenreichen Mikrogliazellen umgeben sein und zeigen in diesem Fall hypointense Ränder in SWI und QSM. Dieser Marker bietet zum einen eine Unterstützung im differenzialdiagnostischen Prozess; zum anderen ermöglicht er eine bessere Unterscheidung zwischen inaktiven und chronisch aktiven Läsionen, z.B. in klinisch progredienten Fällen.42,43
c) Kortikale Läsionen (CLs): Die Beteiligung des Cortex ist ein spezifisches Merkmal der MS, das in frühen Stadien oft übersehen wird. MRT-Techniken wie «Double Inversion Recovery» (DIR) und «Magnetization Prepared 2 Rapid Acquisition Gradient Echoes» (MP2RAGE) verbessern die Sensitivität zur Detektion kortikaler Läsionen und Beteiligung der kurzen kortiko-kortikalen Assoziationsfasern (U-Fasern) erheblich.44–46
d) Diffusions-Tensor-Bildgebung (DTI): Diese Technik misst die Diffusion von Wassermolekülen im Gewebe und ermöglicht die Untersuchung mikrostruktureller Veränderungen in der weissen und grauen Substanz. DTI-Auffälligkeiten korrelieren mit Krankheitsprogression und Behinderungsausmass.47
Ultrahochfeld-MRT: Verbesserung der Differenzialdiagnostik und Verlaufsbeurteilung der Multiplen Sklerose
Aktuelle Studien belegen die hohe prädiktive Leistungsfähigkeit der neuen MRT-Marker in der Differenzialdiagnostik und Verlaufskontrolle der MS. Eine multizentrische Beobachtungsstudie zeigte, dass eine Kombination aus CVS, PRL und CL die Spezifität und Sensitivität der MS-Diagnose signifikant verbessert.48 Trotz ihrer hohen Sensitivität ist die Spezifität der 3T-MRT für MS begrenzt, insbesondere in der Differenzialdiagnostik zu anderen neuroinflammatorischen und neurodegenerativen Erkrankungen.49 Fortschrittliche Bildgebungstechniken können die diagnostische Präzision verbessern und pathophysiologisch relevante Marker gezielt darstellen (s. Tabelle 2).
Mit der Einführung der 7-Tesla (7T)- oder Ultrahochfeld-MRT, welche am Zentrum der Autor:innen routinemässig durchgeführt werden kann, eröffnen sich neue Möglichkeiten zur hochauflösenden Darstellung MS-spezifischer Läsionen, insbesondere bei der Detektion und Charakterisierung der intrakortikalen und juxtakortikalen Läsionen der zentralen Venen sowie zur Charakterisierung paramagnetische Ringläsionen.40
Der Einsatz der 7T-MRT in der klinischen Praxis könnte künftig die diagnostische Präzision weiter erhöhen, insbesondere in frühen Krankheitsstadien oder bei Unklarheiten im differenzialdiagnostischen Prozess. Darüber hinaus bieten fortschrittliche Bildgebungsverfahren neue Möglichkeiten zur Überwachung therapeutischer Interventionen und zur personalisierten Patientenversorgung, z.B. mit präziser Darstellung der paramagnetischen Ringläsionen unter Therapie.50
Die Hochfeld- und Ultrahochfeld-MRT stellen somit einen vielversprechenden Fortschritt in der MS-Diagnostik dar und könnte langfristig zu einer verbesserten Früherkennung, differenzierteren Klassifikation und gezielteren Therapieentscheidung beitragen.51
Therapie der Multiple Sklerose
Das Hauptziel der Therapie der MS besteht darin, die zugrundeliegende Entzündungsreaktion zu kontrollieren, um damit funktionelle Einschränkungen zu vermeiden, Begleitsymptome zu lindern und die langfristige Autonomie der Patient:innen zu erhalten sowie deren Lebensqualität zu verbessern.52,53 Kaum ein Bereich der Neurologie hat in den vergangenen Jahren eine derart dynamische Weiterentwicklung erlebt wie die Therapielandschaft der MS. Die Zahl der DMTs mit unterschiedlichen Wirksamkeits- und Sicherheitsprofilen für sowohl schubförmige (RMS) als auch progrediente MS-Formen ist in den letzten Jahren erheblich gestiegen.54
Trotzdem bleibt die MS bislang eine nicht heilbare Erkrankung, sodass ein multimodaler Therapieansatz erforderlich ist. Dieser umfasst:
-
Immuntherapie zur Schubprophylaxe und Verhinderung der Behinderungsprogression (Basistherapie und eskalierende krankheitsmodifizierende Therapien)
-
Schubtherapie (bei schubförmigem Verlauf)
-
Symptomatische Therapien (medikamentös und nicht-medikamentös)
Die Behandlung der RMS hängt von vielerlei Faktoren ab, wie z.B. Aktivität der Erkrankung, Komorbiditäten oder potentielle Familienplanung.
Eine Einteilung der verfügbaren Therapien kann nach verschiedenen Kriterien erfolgen wie z.B. der Wirksamkeit (eskalierendes oder direkt hochwirksames Therapieprinzip), dem Wirkmechanismus (Immunmodulation, -depletion oder Induktionstherapie) oder -insbesondere wichtig aus Sicht der Betroffenen- der Applikationsform (oral, subkutan, intravenös) und dem Einnahmeintervall.55,56
Mit der zunehmenden Verfügbarkeit von hochpotenten Immuntherapien rücken Sicherheitsaspekte und das Management möglicher Nebenwirkungen immer stärker in den Fokus. Eine sorgfältige Risikoevaluation und Langzeitüberwachung sind essenziell, um das Nutzen-Risiko-Profil der einzelnen Therapien individuell zu optimieren. Die Vigilanz für Infektionen, opportunistische Erkrankungen wie die Progressive Multifokale Leukoenzephalopathie (PML) und sekundäre Autoimmunreaktionen ist dabei von entscheidender Bedeung.57,58
Die kontinuierlichen Fortschritte in der MS-Therapie ermöglichen mittlerweile eine immer präzisere und individuellere Steuerung der Behandlung, um sowohl Krankheitsprogression als auch Schübe effektiv zu minimieren. Zukünftige Entwicklungen könnten das Therapiespektrum weiter ausbauen – möglicherweise mit einem langfristigen Ziel einer krankheitsmodifizierenden Remission oder gar einer Heilungsperspektive.
Die Zukunft bei den Behandlungsoptionen
In den letzten Jahren hat sich die therapeutische Landschaft der MS erheblich erweitert. Zahlreiche DMTs stehen mittlerweile zur Verfügung, doch die Entwicklung neuer Substanzen schreitet weiter voran. Zukünftige neue Medikamente und Behandlungsansätze stellen der monoklonale Antikörper Ublituximab sowie die Bruton-Tyrosinkinase (BTK)-Inhibitoren wie z.B. Tolebrutinib oder die in Studien untersuchte CAR-T-Zelltherapie (Chimeric Antigen Receptor T-Cell Therapy) dar.59–61
Ublituximab
Ublituximab ist ein monoklonaler Antikörper, der – ähnlich wie Rituximab, Ocrelizumab und Ofatumumab – gegen das CD20-Antigen auf B-Lymphozyten gerichtet ist. Durch die Depletion dieser Zellen, die eine zentrale Rolle in der Pathogenese der MS spielen, entfaltet Ublituximab seine Wirkung.59
Im Vergleich zu anderen anti-CD20-Antikörpern weist Ublituximab Unterschiede im Design und Wirkmechanismus auf. Die B-Zell-Depletion erfolgt primär über eine antikörperabhängige zelluläre Zytotoxizität (ADCC) anstelle der komplementabhängigen Zytotoxizität (CDC), wie es bei Rituximab und Ofatumumab der Fall ist. Auch Ocrelizumab zeigt eine vorwiegend ADCC-vermittelte Wirkung, jedoch in geringerem Ausmass als Ublituximab.59
Die Wirksamkeit von Ublituximab wurde in den Phase-III-Studien ULTIMATE I und II im Vergleich zu Teriflunomid untersucht. In der ULTIMATE-I-Studie nahmen 549 Patienten, in ULTIMATE II 545 Patienten mit RMS teil. Über einen Zeitraum von 96 Wochen zeigten sich im Vergleich zum Komparator Teriflunomid signifikant niedrigere Schubraten und weniger MRT-Läsionen, jedoch konnte interessanterweise keine signifikante Reduktion der Behinderungsprogression erreicht werden.59 Die letzte Beobachtung kann in den Augen der Autor:innen dieser Arbeit auf die Bedeutung der Behinderungsprogression durch PIRA hinweisen.
Am 31. Mai 2023 wurde Ublituximab von der Europäischen Kommission (EC) für die Behandlung erwachsener Patienten mit aktiver schubförmiger MS zugelassen.62 In der Schweiz ist das Medikament derzeit (Stand März 2025) noch nicht verfügbar.
Evobrutinib
Obwohl verfügbare DMTs Schübe und eine damit verbundene Krankheitsprogression bei Patienten mit RRMS häufig gut kontrollieren können, bleibt die von PIRA eine therapeutische Herausforderung. PIRA ist mit einem erhöhten Risiko für eine permanente Behinderung assoziiert und wird durch eine chronische ZNS-Entzündung vorangetrieben, gegen die klassische DMTs nur eine begrenzte Wirkung zeigen.63
Evobrutinib ist ein selektiver BTK-Hemmer, der in den B-Zellen eine zentrale Rolle bei Reifung, Aktivierung und Zytokinproduktion spielt. Darüber hinaus beeinflusst BTK auch die Mikroglia, welche an den entzündlichen Prozessen im ZNS beteiligt ist. Aufgrund seiner geringen Molekülgrösse kann Evobrutinib die Blut-Hirn-Schranke überwinden und direkt im ZNS wirken.63 In einer Phase-II-Studie konnte Evobrutinib eine gute Verträglichkeit und eine Reduktion der Krankheitsaktivität bei Patienten mit RMS zeigen.64 In den Phase-III-Studien Evolution RMS1 und Evolution RMS2 wurde die Wirksamkeit jedoch nicht bestätigt, da es in keinem Endpunkt dem Teriflunomid gegenüber überlegen war.61 Die Autor:innen der Studie kamen zu dem Schluss, dass Evobrutinib Teriflunomid in der Wirksamkeit nicht überlegen war und dass die leberbezogenen Nebenwirkungen den breiten Einsatz bei RMS limitieren. Die Entwicklung von Evobrutinib ist pausiert worden, weitere Studien sind derzeit nicht geplant.
Tolebrutinib
Tolebrutinib ist ein weiterer BTK-Inhibitor mit ähnlichem Wirkmechanismus wie Evobrutinib.60,65 In der Phase-III-Studie HERCULES wurde gezeigt, dass Tolebrutinib bei Patienten mit nicht-schubförmiger, sekundär progredienter Multipler Sklerose (nrSPMS) das Auftreten einer 6-monatigen bestätigten Behinderungsprogression im Vergleich zu Placebo um 31% verzögerte (HR: 0,69; p=0,0026).66
Eine weitere Analyse der sekundären Endpunkte ergab, dass sich die Anzahl der Teilnehmer, bei denen sich die Behinderung verbesserte, unter Tolebrutinib verdoppelte im Vergleich zu Placebo (10% vs 5%; HR: 1,88; p=0,021). Die Rate der Patienten mit erhöhten Leberenzym-Werten stieg von 1,6% in der Placebogruppe auf 4,1% in der Tolebrutinib-Gruppe an.66
In den Phase-III-Studien GEMINI 1 und 2, die Tolebrutinib versus Teriflunomid bei RRMS untersuchten, konnte keine Verbesserung der annualisierten Schubrate (ARR) durch Tolebrutinib im Vergleich zum Teriflunomid gezeigt werden wobei die ARR in beiden Gruppen mit ca. 0.1 als sehr niedrig festzuhalten ist. Eine gepoolte Analyse ergab eine Reduktion der Behinderungsprogression um 29% (HR: 0,71; p=0,023), was auf eine potenzielle Wirkung auf schwelende Neuroinflammation hinweisen kann. Die Phase-III-Studie PERSEUS zur Untersuchung von Tolebrutinib bei PPMS läuft derzeit. Ergebnisse werden für das 2. Halbjahr 2025 erwartet.66
CAR-T-Zelltherapie
Die CAR-T-Zelltherapie (Chimeric Antigen Receptor T-Cell Therapy) ist eine innovative Form der personalisierten Immuntherapie aus dem Bereich der T-Cell Engaging Treatments, die ursprünglich zur Behandlung hämatologischer Malignome entwickelt wurde. Andere Varianten der T-Cell Engaging Treatments sind die bi-/trispezifischen Antikörper sowie die Tumor Infiltrating Lymphoycytes (TILI). Bei der CAR-T-Zelltherapie werden körpereigene T-Zellen der Patient:innen mittels viraler Vektoren modifiziert, sodass sie einen chimären Antigenrezeptor (CAR) gegen ein spezifisches Antigen exprimieren. Dieser ermöglicht es den T-Zellen, gezielt spezifische Oberflächenmarker auf krankhaften Zellen zu erkennen und zu eliminieren.67
Während die CAR-T-Zelltherapie in der Onkologie, insbesondere in der Behandlung von B-Zell-Lymphomen, bereits etabliert ist und diese revolutioniert hat, zeichnet sich zunehmend ihr Potenzial in der Neurologie ab, sowohl für eindeutig Antikörper vermittelte Erkrankungen wie die Neuromyelitis-Spektrums-Erkrankung (NMOSD) oder die Myasthenie Gravis (MG), aber auch für solche ohne klaren pathognomonischen Antikörper wie die MS. Studien zur MS sind hier bereits auf dem Weg und werden auch in der Schweiz durchgeführt (NCT06617793).67,68
Conclusions / Ausblick
Die Diagnostik und Therapie der MS haben in den letzten Jahren erhebliche Fortschritte gemacht. Besonders die Einführung der Ultrahochfeld-MRT (7T) hat das Potenzial, die Diagnosesicherheit zu erhöhen und eine differenziertere Verlaufsbeurteilung zu ermöglichen.40–42
Das CVS hat sich als vielversprechender Marker für die Differenzialdiagnostik etabliert.41,42 Bei der Revision der McDonald-Kriterien werden neben diesem29 auch neue MRT-Technologien und Biomarker wie freie Leichtketten Kappa und die paramagnetische Ringläsion in die neue Revision der McDonald-Kriterien einbezogen werden.61
Die zunehmende Integration bildgebender Marker wie des CVS, der paramagnetischen Ringläsionen (PRL) und kortikalen Läsionen (CL) ermöglicht eine genauere Unterscheidung von MS-typischen Läsionen gegenüber anderen neuroinflammatorischen und neurodegenerativen Erkrankungen. Dies könnte die Frühdiagnose weiter verbessern und die Therapieentscheidung gezielter steuern.48,49
Auch Liquor- und Serum-Biomarker, darunter das sNfL und GFAP, gewinnen an Bedeutung. Sie tragen zur genaueren Einschätzung der Krankheitsaktivität bei und könnten in Zukunft gezieltere Therapieentscheidungen unterstützen.34,36,37
Im therapeutischen Bereich erweitert sich das Spektrum an hochwirksamen Immuntherapien. Ublituximab, ein in der EU schon zugelassener neuer CD20-Antikörper,62 konnte in Phase-III-Studien eine signifikante Reduktion der Schubrate zeigen.59 Die Bruton-Tyrosinkinase-Inhibitoren (BTKi) zeigen ein differenziertes Bild: Während Tolebrutinib60,65 in Phase-III-Studien offenbar positive Ergebnisse in der Verzögerung der Behinderungsprogression bei nicht-schubförmiger sekundär progredienter MS erzielte,66 blieb Evobrutinib hinter den Erwartungen zurück.61,64 Zudem könnte die CAR-T-Zelltherapie als neuer Therapieansatz langfristig neue Perspektiven eröffnen, befindet sich jedoch noch in frühen klinischen Studien.67,68
Zusammenfassend ermöglichen moderne MRT-Techniken, bildgebende und labordiagnostische Biomarker und neue Immuntherapien eine immer individuellere Steuerung der MS Therapie. Während die Diagnostik zunehmend präziser wird, nehmen auch die therapeutischen Optionen zu, insbesondere für progrediente Verlaufsformen. In den kommenden Jahren wird sich zeigen, wie diese Fortschritte die klinische Praxis weiter verbessern.
Interessenskonflikte
Hammer H hat an von Almirall, Biogen, BMS, Mercke, Novartis, Roche und Teva gesponserten Treffen teilgenommen und dafür Honorare oder Reisekostenerstattungen erhalten. Sie hat ausserdem Honorare für Beratertätigkeiten von Roche und Fluentis erhalten.
Hoepner R erhielt ein Honorar als Referent/Berater von Merck, Novartis, Roche, Biogen, Alexion, Sanofi, Janssen, Bristol-Myers Squibb, Teva/Mepha und Almirall. Er erhielt in den letzten 5 Jahren Forschungsunterstützung von Roche, Merck, Sanofi, Biogen, Chiesi und Bristol-Myers Squibb. Er erhielt ausserdem Forschungsstipendien von der Schweizerischen MS-Gesellschaft und dem SITEM Insel Support Fund und ist Mitglied des Beirats der Schweizerischen und Internationalen MS-Gesellschaft. Er ist ausserdem stellvertretender Chefredakteur des Journal of Central Nervous System Disease und Mitglied des ECTRIMS Young Investigator Committee.
Radojewski R. hat keine Intressenkonflikte, die mit dieser Arbeit verbunden sind.
Finanzierung
Die Autoren erklären, keine finanzielle Unterstützung von einer Organisation für die eingereichte Arbeit erhalten zu haben.
Autorenbeiträge
Die Autoren haben das Manuskript verfasst und es genehmigt.