Asthma bronchiale ist eine heterogene, multifaktorielle, chronisch-entzündliche Erkrankung der Atemwege, die durch eine bronchiale Hyperreagibilität und/oder eine variable Atemwegsobstruktion charakterisiert ist.1 Dabei unterscheidet man grundsätzlich zwischen dem Typ-2-high Asthma-Endotyp mit allergischem und eosinophilem Phänotyp sowie Mischformen und dem Typ-2-low Asthma-Endotyp mit dem neutrophilen und paucigranulärem Phänotyp.2 Charakteristische Symptome sind Luftnot, Brustenge, Giemen und Husten mit wechselnder Intensität und Häufigkeit.1 Menschen mit Asthma leiden auch häufig unter einem obstruktiven Schlafapnoesyndrom (siehe Kasten). In der Schweiz ist etwa jedes 10. Kind und jeder 14. Erwachsene von Asthma betroffen.3
Therapieansätze bei Asthma
Die moderne Therapie des Asthmas richtet sich heute häufig nach den GINA-Empfehlungen.4 Patienten mit Asthma zeigen kein einheitliches Krankheitsbild, sondern ein komplexes heterogenes klinisches Spektrum mit individuellen Risikofaktoren.4 Zudem sprechen die Betroffenen unterschiedlich auf therapeutische Interventionen an. Daher sind die GINA-Therapieempfehlungen darauf ausgelegt, die Behandlung individuell optimal einzustellen.4 Asthma ist nicht heilbar, das Asthma-Management zielt daher langfristig darauf ab, eine gute Asthmasymptomkontrolle (Tabelle 1) unter möglichst niedrig dosierter Therapie zu erreichen und das Risiko von Exazerbationen, Atemwegsschäden und medikamentösen Nebenwirkungen zu reduzieren.4
Die Behandlung des Asthmas sollte personalisiert erfolgen und besteht aus der Behandlung von modifizierbaren Risikofaktoren und Komorbiditäten (z. B. Adipositas, Infekte, Allergene, Rauchen) und einer Pharmakotherapie.4 Die medikamentöse Therapie nach GINA besteht aus «Controllern», die ihre Wirkung langsam entfalten und vorbeugend wirken, sowie aus «Relievern» zur kurzfristigen Beeinflussung von Symptomen und zur Behandlung von Exazerbationen. Zu den Controllern gehören sämtliche antiinflammatorische Substanzen (v. a. Kortikosteroide [vor allem ICS], Leukotrien-1-Rezeptorantagonisten (LTRA), aber auch bronchospasmolytisch wirksame Pharmaka wie z. B. langwirksame β2-Sympathomimetika (LABA). ICS reduzieren die Entzündung der Atemwege, kontrollieren die Symptome und verringern das Risiko von Exazerbationen sowie Tod durch Asthma. Die ICS-Therapie kann die mit Exazerbationen verbundene Verschlechterung der Lungenfunktion verbessern. Als Reliever werden kurzwirksame β2-Sympathomimetika (SABA), Anticholinergika und systemische Kortikosteroide (z. B. OCS) eingesetzt. SABA und auch ICS-Formoterol in Kombination werden zur schnellen Linderung der Symptome sowie bei Exazerbationen verwendet. Formoterol gehört zwar zur Wirkstoffgruppe der langwirksamen β2-Sympathomimetika. Die Wirkung beginnt aber auch sehr rasch (nach etwa 30 Sekunden) und hält über ca. zwölf Stunden an. Die Kombination ICS-Formoterol wird gemäss GINA daher zur Verwendung sowohl als Controller, wie auch als Reliever empfohlen.4 Zudem werden Patienten mit schwer zu behandelndem oder schwerem Asthma Zusatztherapien («Add-on»-Therapien) empfohlen.
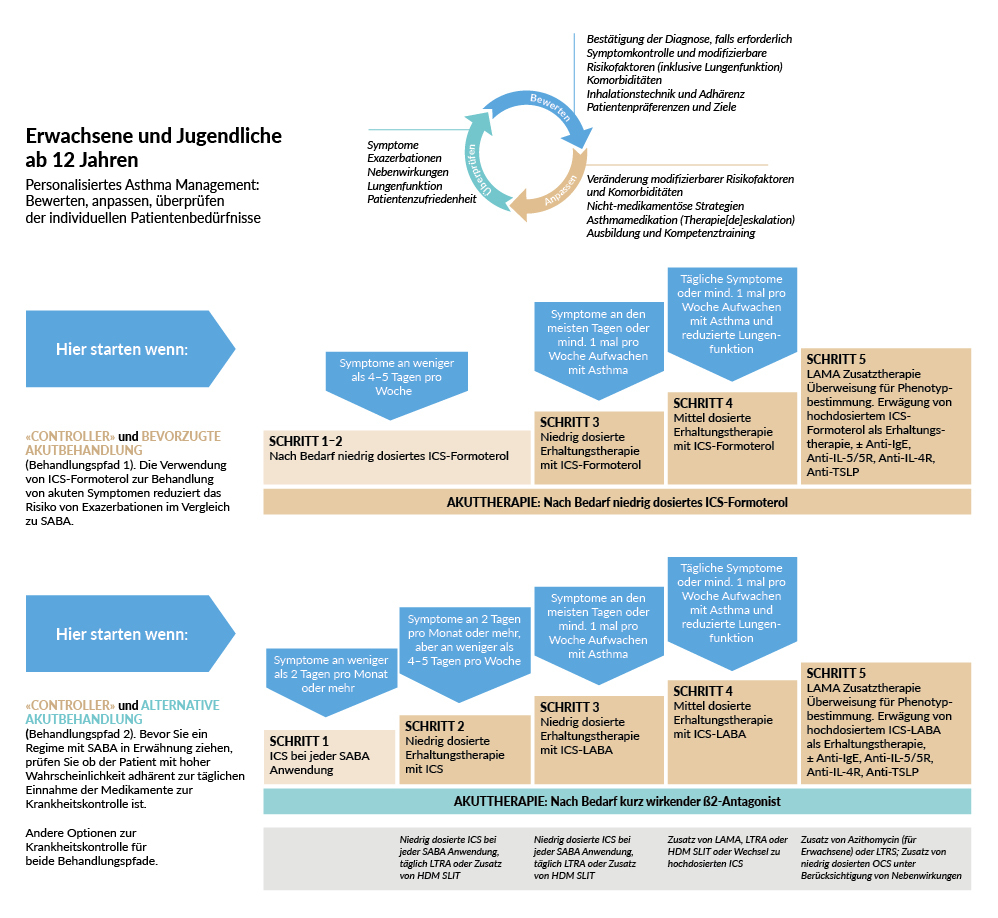
Das Management zum Erreichen der Asthmakontrolle beinhaltet fünf von GINA festgelegte medikamentöse Therapiestufen (Abbildung 1). Diese werden jährlich von GINA überprüft und ggf. modifiziert. Wie seit dem Jahr 2021 festgelegt, wird die Asthmabehandlung von Erwachsenen und Jugendlichen ab 12 Jahren in zwei Behandlungspfade unterteilt, zwischen denen – je nach den Bedürfnissen und Präferenzen des Patienten – gewechselt werden kann (Abbildung 1).
Behandlungspfad 14
Hier wird niedrig dosiertes ICS-Formoterol als «Reliever» in allen Stufen eingesetzt. Dies ist der insgesamt bevorzugte Ansatz, weil er das Risiko von schweren Exazerbationen im Vergleich zu einer SABA-Therapie (mit/ohne Erhaltungstherapie) reduziert und eine ähnliche Symptomkontrolle/Lungenfunktion bei geringerem OCS-Bedarf erreicht. In den Stufen 1 bis 2 sollte niedrig dosiertes ICS-Formoterol nur bei Bedarf eingesetzt werden, in den Stufen 3 bis 5 täglich als Erhaltungstherapie und bei akutem Bedarf («Maintenance-and-Reliever Therapy [MART]»). Es gibt weitere Gründe dafür, in den Stufen 1 bis 2 bei Bedarf ICS-Formoterol gegenüber SABA (allein oder mit täglichen ICS) vorzuziehen:
-
Auch Patienten mit «leichtem» Asthma können schwere Exazerbationen haben.
-
Die Adhärenz gegenüber täglich verordneten ICS ist bei und Patienten mit leichten oder seltenen Symptomen fast durchgängig schlecht. Damit besteht für diese Gruppe ein höheres Risiko für schwere Exazerbationen.
-
Eine Behandlung mit SABA führt dazu, dass die Patienten dies als ihre alleinige Asthma-Behandlung betrachten.
Es besteht eine gute Evidenz, dass bei mildem Asthma der ausschliesslich bedarfsgerechte Einsatz einer Kombination von ICS mit schnellwirksamen Betamimetika in den Therapiestufen 1 und 2 eine gute Option ist, einer bedarfsgerechten SABA Monotherapie überlegen (vor allem hinsichtlich einer Verringerung schwerer Exazerbationen) und gleichwertig mit einer regelmässigen ICS Therapie (bei guter Adhärenz) in Bezug auf die Verringerung von Exazerbationen ist. Bei höhergradigem Asthma ist die Studienlage hierzu geringer, es vermehrt sich aber inzwischen auch hier die Evidenz, dass die o. g. Strategie auch in den Therapiestufen 3 bis 5 die Rate der Exazerbationen und den OCS Bedarf besser senkt, als eine Bedarfstherapie mit einem SABA alleine.
Behandlungspfad 24
Dies ist ein alternativer Ansatz, der z. B. bei Patienten ohne Exazerbationen im letzten Jahr und mit guter Therapieadhärenz empfohlen wird. Bevor eine Behandlung mit einem SABA bei Bedarf in Betracht gezogen wird, ist jedoch zu prüfen, ob von dem Patienten die Erhaltungstherapie mit einem «Controller» eingehalten wird. Obwohl SABA sehr schnell zu einer Besserung von akuten Asthma-Symptomen führt, wurde bei Patienten, die ausschliesslich SABA ohne Controller erhielten, trotz guter Symptomkontrolle ein erhöhtes Risiko für Asthma-bedingte Notfallbehandlungen und Todesfälle beobachtet. Vermehrte SABA-Nutzung wurde mit einem erhöhten Risiko für Exazerbationen und mit höherer Mortalität assoziiert. Aufgrund dieser Erkenntnisse wird eine Behandlung mit SABA ohne eine zusätzliche Erhaltungstherapie (z. B. ICS) nicht empfohlen. Nichteinhaltung der genannten Therapieempfehlung ist mit schlechteren klinischen Resultaten verbunden (einschliesslich Tod, Hospitalisierung und reduzierter Lebensqualität).
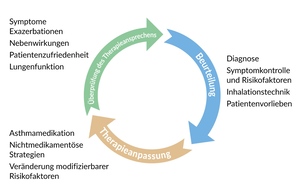
Das Asthmamanagement sollte dann in einem kontinuierlichen Zyklus kontrolliert und ggf. angepasst werden (Abbildung 2).4
Bei einer konsequenten Einhaltung der Therapie gemäss der GINA Empfehlungen ist bei einem Grossteil der Patienten eine gute Asthma-Kontrolle zu erreichen. Je nach Verlauf sollte die medikamentöse Therapie dann auf die niedrigste wirksame Dosis eingestellt werden. Hierzu wird folgende Vorgehensweise empfohlen4:
-
«Step-up» der Asthma Therapie. Bei unzureichender Asthmakontrolle sollten vor einer Therapieeskalation modifizierbare Risikofaktoren (einschliesslich falscher Inhalationstechnik und «Trigger»-Faktoren) identifiziert und ggf. behandelt werden. Je nach Befund und Symptomen kann dann eine Eskalation auf eine höhere Therapiestufe in Erwägung gezogen werden.4
-
«Step-down» der Asthma Therapie. Bei objektiv vorhandener guter Asthmakontrolle ist es wichtig, eine Überbehandlung zu verhindern. Sobald das Asthma 2 bis 3 Monate lang gut kontrolliert ist, sollte daher eine schrittweise Verringerung der Dosis in Betracht gezogen werden, um die minimal wirksame Dosis zu finden. Bei Bedarf kann die Dosis dann wieder erhöht werden.4
Sobald eine gute Asthmakontrolle erreicht ist, sollten weitere Überprüfungen mindestens einmal jährlich erfolgen (häufiger bei schwierig zu behandelndem oder schwerem Asthma, nach einer Exazerbation und nach einem Behandlungswechsel).4
Ein Teil der Patienten zeigt unter einer Therapie bis Stufe 4 nach GINA keine ausreichende Asthmakontrolle, daher werden in Stufe 5 Add-on-Optionen empfohlenen (Abbildung 1). Diese umfassen z. B. langwirksame Muskarin-Antagonist (LAMA) und Biologika.4
Schwierig behandelbares und schweres Asthma
Ein Teil der Patienten erzielt auch unter einer hochdosierten ICS/LABA-Therapie keine ausreichende Asthmakontrolle und hat dadurch eine schlechtere Prognose und Lebensqualität sowie eine erhöhte Mortalität. Um die Prognose dieser Patienten (insbesondere beim schweren Asthma) zu verbessern, wurden die Ursachen des Asthmas und die Faktoren, welche die Asthmakontrolle beeinflussen, in den letzten Jahren weiter intensiv erforscht.
In der Vergangenheit wurden von einigen Fachgesellschaften, Initiativen und Organisationen viele unterschiedliche Terminologien für die Definition des «schweren Asthmas» entwickelt (refraktäres Asthma, unkontrolliertes Asthma, schwierig zu behandelndes Asthma, schweres Asthma, schwieriges Asthma, Therapie resistentes Asthma, schwierig zu kontrollierendes Asthma u. v. a.), was lange zu einer gewissen Verwirrung geführt hat. Zu den globalen Leitlinien und Empfehlungen, die sich intensiver mit schwerem Asthma beschäftigen und die Definition des schweren Asthmas überarbeitet und angepasst haben, gehören der GINA-Bericht6 sowie die Leitlinien der European Respiratory Society (ERS)/American Thoracic Society (ATS) Fachgesellschaften.7 Gemäss ERS/ATS-Leitlinie liegt ein schweres Asthma dann vor, wenn eine optimierte hochdosierte inhalative Therapie benötigt wird, um eine Asthmakontrolle zu ermöglichen und langfristig zu erhalten. Dabei muss die Asthma-Diagnose zunächst bestätigt werden und der Patient über mehr als 3 Monate von einem Asthmaspezialisten hinsichtlich Einflussfaktoren für eine unzureichende Asthmakontrolle beurteilt und ggf. behandelt worden sein. Bevor diese Kriterien nicht erfüllt wurden, handelt es sich noch um ein «schwieriges Asthma». GINA hat 2019 erstmals ein separates Addendum zum Thema «schwierig zu behandelndes und schweres Asthma» veröffentlicht und die Definitionen bei Jugendlichen und Erwachsenen angepasst. Dieses wurde zuletzt 2022 präzisiert. Demnach liegt ein «schwierig zu behandelndes Asthma» vor, wenn trotz mittel- oder hochdosierter ICS-Behandlung und einem zweiten «Controller» (üblicherweise LABA) oder OCS-Erhaltungstherapie die Erkrankung unkontrolliert ist oder wenn eine hochdosierte Behandlung erforderlich ist, um eine gute Symptomkontrolle aufrechtzuerhalten und um das Risiko von Exazerbationen zu reduzieren. Schätzungsweise 17% der Asthmatiker leiden an schwierig behandelbarem Asthma.8
«Schweres Asthma» ist eine Unterform des schwierig zu behandelnden Asthmas (Abbildung 3). Es bezeichnet ein Asthma, das trotz Einhaltung der maximal optimierten hochdosierten ICS-LABA-Therapie und der optimalen Behandlung von Einflussfaktoren für eine unzureichende Asthmakontrolle unkontrolliert ist, oder das sich verschlechtert, wenn die hochdosierte Behandlung verringert wird.6 Einflussfaktoren für eine unzureichende Asthmakontrolle sind unter anderem «Trigger» und Komorbiditäten, die beurteilt und ggf. behandelt werden müssen.6 Meist sind dies Rauchen, gastroösophageale Refluxkrankheit, chronische Rhinosinusitis mit Nasenpolypen (CRSwNP), obstruktive Schlafapnoe, kardiovaskuläre Erkrankungen, Obesitas, Allergien, Umwelteinflüsse, Nebenwirkungen einer Begleitmedikation und rezidivierende Infektionen. Des Weiteren müssen Differentialdiagnosen beurteilt werden, die Asthmasymptome imitieren können, v. a. chronisch-obstruktive Lungenerkrankung (COPD), «Vocal Cord Dysfunction (VCD)», eosinophile Granulomatose mit Polyangiitis (EGPA), Bronchiolitis, Allergische bronchiopulmonale Aspergillose (ABPA), hypereosinophiles Syndrom (HES) und Hypersensitivitätspneumonitis.4,6 Studien legen nahe, dass etwa ein Drittel der Patienten, bei denen Asthma diagnostiziert wurde, kein Asthma haben.5 Auch die Inhalationstechnik sowie Adhärenz muss überprüft und – wenn erforderlich – optimiert werden. Die häufigste Ursache eines Nichtansprechens auf ICS ist eine unzureichende Adhärenz. Selbst bei Patienten mit schwerem Asthma, die sehr anfällig für Exazerbationen sind und eine hohe Symptombelastung haben, nahmen 65% weniger als 80% ihrer verordneten inhalativen Medikation ein.9,10
In einer Studie aus den Niederlanden hatten 17,4% der erwachsenen Asthmapatienten ein «schwer kontrollierbares» Asthma (schlechte Asthmakontrolle trotz Verschreibung einer hochdosierten Behandlung), unter und Patienten mit hoher Adhärenz waren es noch 3,6%.11
Therapie des schweren Asthma
In der Therapie des schweren Asthmas bronchiale zeigt sich zunehmend ein Trend weg von einer «One-size-fits-all»-Therapie zu differenzierteren Strategien. In der Vergangenheit wurde die Therapie des Asthmas überwiegend auf Symptome und Lungenfunktion begrenzt. Liegt ein schweres Asthma mit Exazerbationen oder eine erforderliche Erhaltungstherapie mit systemischen Kortikosteroiden (OCS) vor, sollte die Option einer Biologikatherapie überprüft werden. Eine OCS-Therapie des schweren Asthmas wurde von GINA als nachrangige Reserve zurückgestuft, z. B. wenn Biologika nicht indiziert sind oder nicht vertragen werden. Dies betrifft allerdings nicht den kurzzeitigen Einsatz von OCS bei Exazerbationen.
Die Präzisionsmedizin durch eine Biologikatherapie ist eine auf den Asthma Endo- und Phänotyp ausgerichtete Behandlung. Daher müssen diese zur optimalen Auswahl der Biologika weiter differenziert werden. Neben der Sicherung der Diagnose «schweres Asthma» ist daher eine optimale Evaluation der zugrunde liegenden pathophysiologischen Ursachen durch eine Endo- und Phänotypisierung von zentraler Bedeutung. Für die bestmögliche Auswahl der Biologika ist ein breites Verständnis der Entzündungswege, die bei schwerem Asthma eine Rolle spielen, und ihre verschiedenen Beziehungen zu klinisch verfügbaren Biomarkern erforderlich, um das richtige Biologikum für den richtigen Patienten identifizieren zu können. Hier bietet die Pathophysiologie und Inflammationskaskade des Asthmas verschiedene Ansatzpunkte für neue Behandlungsoptionen (Abbildung 4).13 So gelten die Interleukine 4, 5 und 13 (IL-4, -5 und -13) bei einigen Formen der Erkrankung als Hauptursachen der entzündlichen Reaktionen.13,14 Auch das Immunglobulin E (IgE) spielt eine wichtige Rolle bei der Pathogenese des allergischen Phänotyps. Ein weiteres Target ist das thymus-stroma-lymphopoietin (TSLP), ein Alarmin des Bronchialepithels, das mit seinem Rezeptor interagiert und so die Freisetzung proinflammatorischer Zytokine durch Immunzellen fördert.15
Bei Patienten mit schwerem Asthma sind Biologika die Therapiealternative der 1. Wahl.1 Hier sind in der Schweiz 6 verschiedene monoklonale Antikörper zugelassen, die gegen IL-4/13-Rezeptoren, TSLP, IL-5 oder deren Rezeptoren sowie gegen IgE gerichtet sind (Tabelle 2).
IL4/IL-13-Rezeptorantagonist Dupilumab
Der monoklonale Antikörper Dupilumab bindet an die gemeinsame Komponente des IL-4/IL-13-Rezeptors und hemmt so die Signalwege der inflammatorischen Zytokine IL-4 und IL-13.16 Die Wirksamkeit und Sicherheit der Behandlung konnten bereits in der Phase-III-Studie QUEST22,23 und in der offenen Phase-III-Verlängerungsstudie TRAVERSE,24 an der auch Patienten der QUEST-Studie teilnahmen, gezeigt werden. Die Teilnehmer beider Studien waren ≥12 Jahre alt und litten unter mittelschwerem bis schwerem Asthma. In QUEST erhielten die Patienten 52 Wochen lang Dupilumab (200 oder 300 mg, alle 2 Wochen) oder stattdessen Placebo. In TRAVERSE wurden alle Patienten über bis zu 96 Wochen mit Dupilumab (300 mg, alle 2 Wochen) behandelt. Die Daten der QUEST-Studie zeigten, dass unter Dupilumab die Exazerbationsraten signifikant reduziert werden konnten.23 So betrug die jährliche Rate schwerer Asthma-Exazerbationen 0,46 bei denjenigen Patienten, die alle 2 Wochen 200 mg Dupilumab erhielten, gegenüber 0,87 bei den Patienten der Placebogruppe. Dies entsprach einer um 47,7% niedrigeren Rate unter Dupilumab im Vergleich zu Placebo (p<0,001). Ähnliche Ergebnisse wurden bei einer Dupilumab-Dosis von 300 mg alle 2 Wochen beobachtet mit Exazerbationsraten von 0,52 unter Dupilumab bzw. 0,97 unter Placebo, was einer Verringerung um 46,0% (p<0,001) entsprach. In der Verlängerungsstudie TRAVERSE blieben die bereits in den jeweiligen Elternstudien beobachteten niedrigen jährlichen Exazerbationsraten bei den Patienten, die nicht von oralen Kortikosteroiden abhängig waren, bis zum Ende der Therapie mit Dupilumab in Woche 96 auf einem niedrigen Niveau von 0,277 bis 0,327, je nach Behandlungsgruppe.24 Durch die Behandlung mit dem IL4/IL13-Rezeptorantagonisten Dupilumab konnten die Exazerbationsraten also auch langfristig deutlich verringert werden.
Eine aktuelle Analyse der Daten beider Studien evaluierte nun die kontinuierliche Behandlung mit Dupilumab über einen Zeitraum von bis zu 3 Jahren.25 Insgesamt wurden 549 Patienten eingeschlossen, von denen 364 in QUEST und TRAVERSE durchgehend mit Dupilumab behandelt wurden (Dupilumab/Dupilumab-Arm) und 185 in QUEST zunächst Placebo erhielten und dann in TRAVERSE auf Dupilumab umgestellt wurden (Placebo/Dupilumab-Arm). Zu den analysierten Endpunkten gehörten das FEV1[1], die FVC[2] und der FEF25-75%[3], gemessen jeweils vor Einsatz eines Bronchodilatators. Die Steigungen der prä-bronchodilatatorischen FEV1-Kurven wurden ebenfalls in QUEST und TRAVERSE bestimmt.
-
Im Dupilumab/Dupilumab-Arm verbesserte sich der FEV1-Wert von Beginn der QUEST-Studie an bis zur Woche 96 der TRAVERSE-Studie um 350 ml. Im Placebo/Dupilumab-Arm, führte die Umstellung auf Dupilumab in der TRAVERSE-Studie ebenfalls zur raschen Verbesserung der Lungenfunktion. Bis zur Woche 96 wurde bei diesen Patienten eine Erhöhung des FEV1-Werts um 370 ml erreicht, wobei bereits 2 Wochen nach Therapiebeginn in TRAVERSE eine deutliche Steigerung um 340 ml beobachtet wurde.
-
Weitere Lungenfunktionsparameter verbesserten sich unter Dupilumab in beiden Armen in ähnlicher Weise wie die FEV1-Werte.
-
Die Steigung der prä-bronchodilatatorischen FEV1-Kurve von Woche 4 bis Woche 52 der QUEST-Studie betrug im Dupilumab/Dupilumab-Arm 55 (p=0,0316) gegenüber -4 im Placebo/Dupilumab-Arm. Die Steigung der FEV1-Kurve ist ein Indikator für Atemwegsobstruktionen. Ein abnehmender Wert weisst auf eine Verengung der Atemwege hin. In den Wochen 4 bis 96 der TRAVERSE-Studie waren die prä-bronchodilatatorischen FEV1-Steigungswerte für beide Behandlungsgruppen stabil. Die Steigung der post-bronchodilatatorischen FEV1-Kurve von Woche 4 bis Woche 52 in der QUEST-Studie lag im Dupilumab/Dupilumab-Arm bei 2 gegenüber -67 im Placebo/Dupilumab-Arm (p=0,0160).
Die hier vorgestellten Daten zeigen, dass Patienten mit unkontrolliertem, mittelschwerem bis schwerem Asthma über insgesamt bis zu 3 Jahre von der Behandlung mit Dupilumab profitieren konnten. Dabei verbesserten sich durch die Therapie mehrere Lungenfunktionsparameter, inklusive der grossen und kleinen Atemwege und der fixen Atemwegsobstruktion (Remodelling). Bei den Patienten, die in QUEST Placebo erhielten und erst nach der Teilnahme an TRAVERSE mit Dupilumab begannen, wurden durch die Therapie ebenfalls rasche und anhaltende Verbesserungen der Lungenfunktion erzielt.
Dass die Therapie mit Dupilumab auch den Verbrauch an systemischen Kortikosteroiden deutlich reduzieren kann, belegten die Daten von VENTURA.26 In die Phase-III-Studie wurden 210 Patienten mit Kortikosteroid-abhängigem schwerem Asthma eingeschlossen, die als Add-on-Therapie Dupilumab (300 mg, alle 2 Wochen) oder Placebo erhielten. Dabei wurden die oralen Kortikosteroid-Dosen von Woche 4 bis Woche 20 in einem Abwärtstrend angepasst und dann 4 Wochen lang auf einer stabilen Dosis gehalten. Im Ergebnis konnte die Kortikosteroid-Dosis nach 24 Wochen unter Dupilumab um 70,1% verringert werden, während in der Placebogruppe nur eine Reduktion um 41,9% möglich war (p<0,001). Gleichzeitig führte die Behandlung mit Dupilumab ‒ trotz der reduzierten Kortikosteroid-Dosis ‒ zu einer um 59% niedrigeren Rate an schweren Exazerbationen als unter Placebo.
Die Langzeitsicherheit von Dupilumab wurde in einer Fortsetzungsstudie von TRAVERSE untersucht.27 In die offene Kohortenstudie wurden insgesamt 393 Patienten eingeschlossen, welche die TRAVERSE-Studie24 beendet hatten und dort bereits Dupilumab erhalten hatten. Diese wurden über einen Zeitraum von weiteren maximal 144 Wochen mit dem IL-4/IL-13-Rezeptorantagonisten (300 mg, alle 2 Wochen, subkutan) behandelt. Die Auswertung der Daten zeigte, dass die Therapie mit Dupilumab auch langfristig gut vertragen wurde. Insgesamt berichteten 9,4% der Patienten über ≥1 therapiebedingtes TEAE[4], von denen keines als schwerwiegend eingestuft wurde. Die Sicherheitsergebnisse stimmten mit dem bekannten Sicherheitsprofil von Dupilumab überein.
TSLP-Hemmer Tezepelumab
Der monoklonale Antikörper Tezepelumab bindet an das Zytokin TSLP und verhindert so dessen Interaktion mit seinem Rezeptor.17 Dadurch wird die Freisetzung proinflammatorischer Zytokine durch Immunzellen reduziert. Die Wirksamkeit und Sicherheit der Therapie wurden in einer Post-hoc-Analyse von gepoolten Daten der Phase-IIb-Studie PATHWAY28 und der Phase-III-Studie NAVIGATOR29 untersucht.30 In die Analyse wurden 1334 Patienten im Alter von 18‒75 Jahren (PATHWAY) bzw. 12‒80 Jahren (NAVIGATOR) mit schwerem, unkontrolliertem Asthma eingeschlossen, die über 52 Wochen mit Tezepelumab (210 mg, alle 4 Wochen; N=665) behandelt wurden oder stattdessen Placebo erhielten (N=669). Die Auswertung der Daten brachte folgende Ergebnisse:
-
Tezepelumab reduzierte in der Gesamtpopulation die AAER[5] im Vergleich zu Placebo innerhalb von 52 Wochen um 60% (RR[6]: 0,40; [95% KI: 0,34 bis 0,48]). Dabei konnte sowohl bei Patienten mit einer hohen als auch einer niedrigen Konzentration von Entzündungsmarkern wie BEC[7] bzw. FeNO[8] eine deutliche Verbesserung der AAER erreicht werden.
-
Tezepelumab verringerte auch die exazerbationsbedingten Spitalaufenthalte oder Besuche in der Notaufnahme um 79% (RR: 0,21 [95% KI: 0,13 bis 0,35]) im Vergleich zur Placebogruppe.
-
Gleichzeitig wurde die Behandlung mit dem TSLP-Hemmer gut vertragen. Die Häufigkeit von unerwünschten Ereignissen war in beiden Behandlungsgruppen vergleichbar (74,6% unter Tezepelumab vs 76,5% unter Placebo).
Tezepelumab führte also bei Patienten mit schwerem, Asthma zu einer klinisch relevanten Verringerung der Exazerbationen und darüber hinaus zu weiteren Verbesserungen der Lungenfunktion, Asthmakontrolle und Lebensqualität, wobei alle klinisch relevanten Subgruppen von der Therapie profitierten. Der Verbrauch an oralen Kortikosteroiden konnte durch Tezepelumab in der Gesamtpopulation jedoch nicht signifikant reduziert werden (OR[9]: 1,28; p=0,43), wie die Daten der Phase-III-Studie SOURCE zeigten.31 Allerdings hatten die Patienten, die eine Eosinophilenzahl von mindestens 150 Zellen/μl aufwiesen, eine deutlich höhere Chance, dass der Verbrauch an Kortikosteroiden durch die Therapie verringert wurde, als die übrigen Studienteilnehmer (OR: 2,58 vs 0,40). Bei guter Verträglichkeut hat Tezepelumab hat eine signifikante Reduzierung der AAER sowie der Spitalaufenthalte.
Anti-IL5-Biologika
In der Schweiz werden Stand April 2024 drei monoklonale Antikörper angeboten, die gegen IL-5 oder dessen Rezeptor gerichtet sind und als Zusatztherapie von schwerem Asthma indiziert sind:
-
Mepolizumab:18 Die Substanz bindet spezifisch an IL-5 und blockiert so dessen entzündliche Wirkung. Die auch langfristig gute Wirksamkeit von Mepolizumab wurden unter anderem in einer Beobachtungsstudie des SANI-Registers nachgewiesen, in der die Exazerbationsrate nach dreijähriger Therapie von 3,9 auf 0,2 und damit um rund 95% im Vergleich zum Ausgangswert gesenkt werden konnte.32 Der tägliche Verbrauch an oralen Kortikosteroiden (OCS) wurde von 15,0 mg Prednison-Äquivalent zu Therapiebeginn auf 6,3 mg nach 3 Jahren reduziert (p=0,046).32 Die Rate der OCS-abhängigen Patienten verringerte sich unter Mepolizumab von 54% zu Therapiebeginn auf 6% nach drei Jahren (p<0,001 im Vergleich zum Ausgangswert).
-
Reslizumab:19 Das Medikament bindet ebenfalls spezifisch an IL-5. In einer Post-hoc-Analyse von zwei Phase-III-Studien an exazerbationsanfälligen Patienten mit schwerem eosinophilem Asthma wurde gezeigt, dass Reslizumab die Exazerbationsrate deutlich verringern konnte.33 So betrug die jährliche Rate an klinischen Exazerbationen unter dem IL5-Hemmer 1,07 gegenüber 3,02 unter Placebo bei den Patienten, die im Jahr zuvor mindestens zwei klinische Exazerbationen erlitten hatten (RR: 0,35). Auch die Jahresrate der Verschreibungen von systemischen Kortikosteroiden war unter Reslizumab bei diesen Patienten niedriger als unter Placebo (0,7 vs 1,6). In einer offenen Extensionsstudie wurde zudem gezeigt, dass Lungenfunktion und Asthmakontrolle bei den Reslizumab-erfahrenen Patienten mit moderatem bis schwerem Asthma über bis zu 2 weitere Jahre stabilisiert und bei den therapienaiven Patienten nachhaltig verbessert wurden.34 Dabei gab es auch nach 2 Jahren keine neuen Sicherheitssignale.
-
Benralizumab:20 Der Wirkstoff bindet mit hoher Affinität an den IL-5-Rezeptor, der auf der Oberfläche der eosinophilen Granulozyten lokalisiert ist. In der Folge kommt es zur deren Apoptose und somit zur nahezu vollständigen Depletion mit Reduktion der eosinophilen Entzündungsreaktion. In der retrospektiven Beobachtungsstudie ANANKE kam es nach 96 Wochen unter Benralizumab zur Verbesserung der AAER um 94,9% und der schweren AAER um 96,9% gegenüber dem Ausgangswert.35 Die mediane Dosis der täglich verordneten oralen Kortikosteroide (OCS) konnte unter Benralizumab nach 48 und 96 Wochen von 10 mg Prednison-Äquivalent (5 bis 25 mg) auf jeweils 0 mg (0 bis 5 mg) reduziert werden. Dabei wurde die OCS-Dosierung bei 61,8% bzw. 66,7% der Patienten verringert, wobei die Mehrzahl eine Dosisreduktion von 90% oder mehr im Vergleich zur Anfangsdosis erreichte.
Alles in allem sind die Anti-IL5-Biologika in der Lage die Exazerbationsrate längerfristig zu reduzieren. Zudem haben sie einen positiven Einfluss auf andere Kritieren, zum Beispiel eine Verringerung der OCS Dosis.
IgE-Inhibitor Omalizumab
Der monoklonale Antikörper Omalizumab blockiert selektiv IgE, verhindert damit dessen Bindung an den IgE-Rezeptor auf Basophilen und Mastzellen und wirkt so antientzündlich.21 In einer Metaanalyse von 86 Beobachtungsstudien wurde gezeigt, dass die Patienten (≥6 Jahre) mit schwerem allergischem Asthma von Omalizumab profitierten.36 So konnte die jährliche Rate schwerer Exazerbationen durch die Therapie mit dem IgE-Inhibitor signifikant um 59% reduziert werden (RR: 0,41; p<0,01). Das FEV1 verbesserte sich nach 16 Wochen, 6 Monaten und 12 Monaten durchschnittlich um 160, 220 bzw 250 ml. Die Anzahl der Patienten, die orale Kortikosteroide benötigten, verringerte sich nach 12-monatiger Therapie mit Omalizumab um 41% (RR: 0,59; p<0,01). Bei 57% der Patienten wurde innerhalb von einem Jahr eine Reduktion der OCS-Dosis um mindestens 20% erreicht. Auch die Anzahl der ungeplanten Arztbesuche konnte innerhalb von 12 Monaten um 2,34 gesenkt werden. Omalizumab ist eine Option für Patienten mit schwerem allergischem Asthma und Exazerbationen im letzten Jahr.
Vorgehensweise bei der Behandlung des schweren Asthmas mit Biologika
Bei einem schweren Asthma kann anhand von Parametern wie vor allem Bluteosinophilie und FeNO sowie den Spezifizierungen in den Fachinformationen, entschieden werden welches Biologika am besten zum Patienten passt. Für die Entscheidung, ob und welches Biologikum zur Behandlung von schwerem Asthma eingesetzt werden sollte, existieren viele verschiedene Methoden zur Beurteilung und Auswahl und jede hat ihre Stärken und Schwächen. Zur Auswahl der Biologikatherapie werden häufig die GINA-Kriterien herangezogen.4,6
Allerdings kann kein Biomarker oder deren Kombination das Ansprechen der Patienten auf eine gezielte Biologikatherapie ausreichend sicher voraussagen. Zunehmend setzen sich daher multidimensionale Auswahlkriterien unter Einbezug weiterer Kriterien durch (Abbildung 5)1: nach derzeitigem Erkenntnisstand hat die Kombination BEC und FeNO den besten prognostischen und prädiktiven Wert und beide Biomarker sollten bei Patienten mit schwerem Asthma immer bestimmt werden. Zudem ist die Beurteilung einer Allergie erforderlich. Des Weiteren sollten klinische Merkmale (v. a. die OCS-Abhängigkeit) beurteilt werden. Auch sollten komorbide Erkrankungen die mit einer Typ-2 Inflammation assoziiert sind (z.B. CRSwNP) sowie Sicherheitsüberlegungen hinsichtlich der Therapie beurteilt werden (Behandlungsadhärenz, Schwangerschaft, Gebrechlichkeit, body mass index (BMI) und Alter u. a).
Interessenskonflikt
Der Autor hat ausserhalb dieses Manuskripts wirtschaftliche Beziehungen mit den folgenden Unternehmen für Vortrags/Schulungstätigkeiten: Boehringer, AstraZeneca, GSK, OM Pharma, Sanofi Aventis.
Finanzierung
Der Autor erklärt, keine finanzielle Unterstützung von einer Organisation für die eingereichte Arbeit erhalten zu haben.
Autorenbeiträge
Der Autor hat das Manuskript verfasst und es genehmigt.
FEV1: forciertes exspiratorisches Volumen in 1s
FVC: forcierte Vitalkapazität
FEF25–75%: forcierter exspiratorischer Fluss bei 25–75% des Lungenvolumens
TEAE: behandlungsbedingte unerwünschte Effekte
AAER: jährliche Asthma Exazerbationsrate
RR: relatives Risiko
BEC: Eosinophilenzahl im Blut
FeNO: fraktioniertes ausgeatmetes Stickoxid
OR: Chancenverhältnis (Odds Ratio)
CPAP: Continuous Positive Airway Pressure

_2023.jpeg)



_2023.jpeg)

