Einführung
Die Psoriasis (Schuppenflechte) ist eine chronische entzündliche, systemische Erkrankung, die sich vor allem durch typische Hautveränderungen äussert und meist schubförmig verläuft.1 In der Schweiz sind etwa 170’000 Menschen davon betroffen.2 Bei rund 25% nimmt die Erkrankung einen mittelschweren bis schweren Verlauf.2 Dabei ist die Plaque-Psoriasis (Psoriasis vulgaris), die durch erythrosquamöse Hautstellen («Plaques») vor allem an Ellenbogen, Knien, Kreuzbein, Kopfhaut, gekennzeichnet ist, mit etwa 90% die häufigste Form.1–4 Die Patienten, die daran erkrankt sind, haben ein erhöhtes Risiko für Arthritis («Psoriasis-Arthritis», ca. in 30% der Fälle) und weitere Komorbiditäten wie entzündliche Darmerkrankungen (z. B. Morbus Crohn), metabolisches Syndrom, kardiovaskuläre Erkrankungen, nicht-alkoholische Steatohepatitis und Depressionen.5 Die Plaque-Psoriasis stellt daher für die Betroffenen oft eine hohe medizinische Belastung dar, die die Lebensqualität erheblich einschränken kann.3,4 Vor diesem Hintergrund besteht nach wie vor ein Bedarf an wirksamen Therapien. Hier haben sich Biologika, insbesondere Inhibitoren der Interleukine IL-17 und IL-23 mittlerweile als wichtige Behandlungsoptionen bei mittelschwerer bis schwerer Plaque-Psoriasis etabliert.3,6
Hemmung der Interleukine IL-23 und IL-17 als Ansatz für eine gezielte Therapie der Plaque-Psoriasis
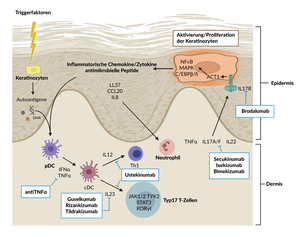
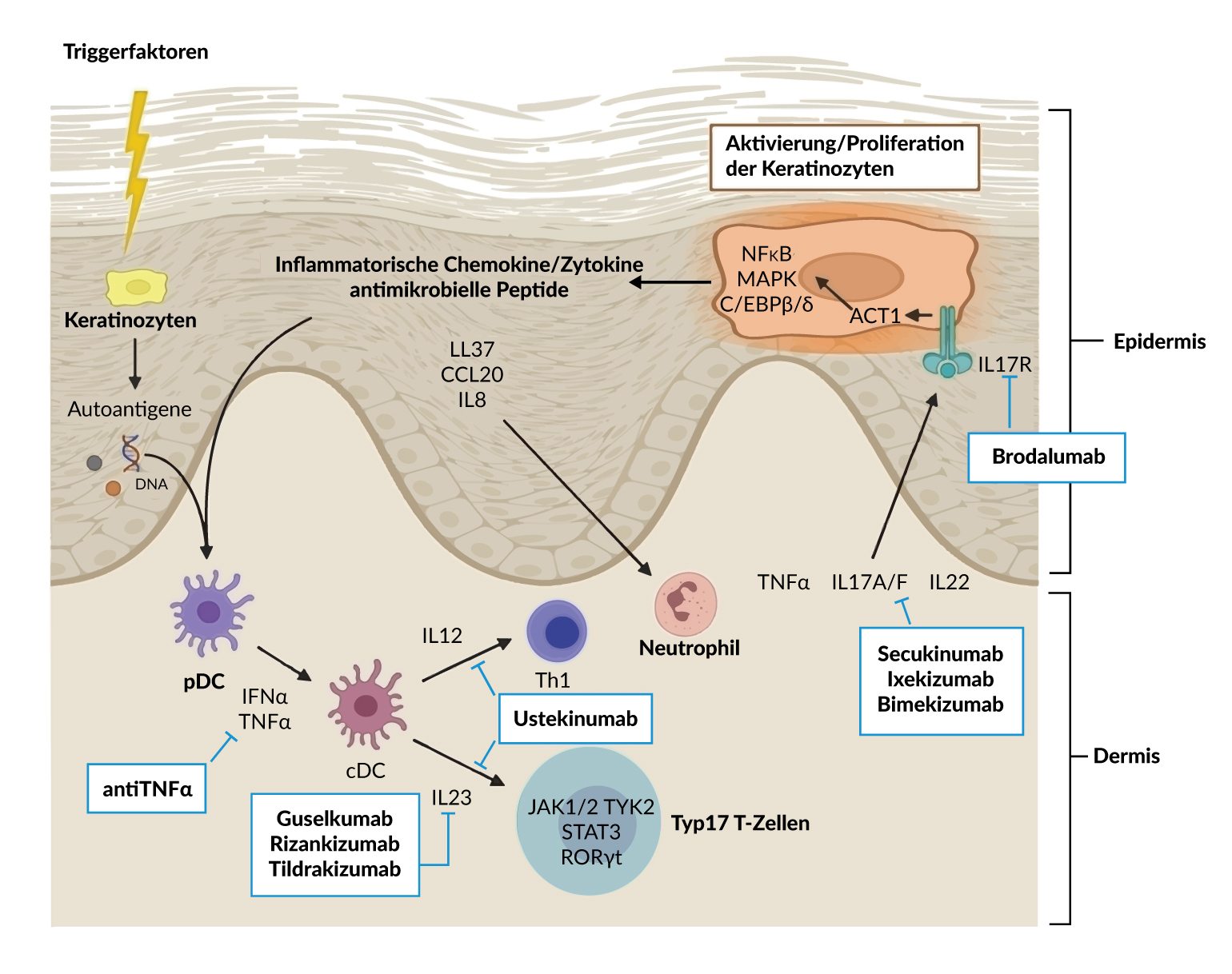
Bei der Ätiopathogenese der Psoriasis spielen neben einer genetischen Prädisposition, zahlreiche Triggerfaktoren wie Hautreizungen/-irritationen, Infektionen, Medikamente oder psychische Belastungen und Stress sowie eine Fehlfunktionen im Immunsystem (aberrante IL-23/IL-17-Achse) eine zentrale Rolle (Abbildung 1).1,3 Postuliert wird, dass verschiedene dendritischen Zellen und v.a. Typ-17 T-Zellen durch (Auto)-Antigene stimuliert werden.3 Hierbei produzieren die dendritischen Zellen ‒ zusammen mit Makrophagen ‒ unter anderem das Interleukin IL-23, das an den IL-23-Rezeptor der Typ-17 T-Zellen bindet und so deren Überleben und Proliferation stimuliert.3 Daraufhin bilden die Typ-17 T-Zellen verschiedene Formen von IL-17 (IL-17A, IL-17F), IL-22 und TNF-α, die dann die Keratinozyten in der Epidermis aktivieren und somit deren Wachstum und Vermehrung induzieren.- In der Folge setzen die Keratinozyten inflammatorische Zytokine und Chemokine frei und es entwickeln sich entzündliche Plaques, die das typische klinische Bild der Erkrankung ausmachen.3 Die Interleukine IL-23 und IL-17 sind demnach ‒ neben anderen Zytokinen wie TNF-α7‒ Targets für die systemische Therapie der Plaque-Psoriasis (Abbildung 1).3
IL-17- und IL-23-basierte Therapieoptionen
Im Folgenden werden einige Behandlungsmöglichkeiten der Plaque-Psoriasis mit den Interleukinen IL-17 bzw. IL-23 als Target und aktuelle Studiendaten hierzu vorgestellt. Die monoklonalen Antikörper gegen IL-17 und IL-23 sind für die Behandlung von Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis indiziert, die für eine systemische Therapie in Frage kommen. Für die Übernahme der Behandlungskosten besteht folgende Limitatio: Behandlung erwachsener Patienten mit schwerer Plaque-Psoriasis, bei denen eine Phototherapie oder eine der folgenden konventionellen systemischen Therapien (Ciclosporin, Methotrexat, Acitretin) keinen therapeutischen Erfolg gezeigt haben.
IL-17 Inhibitoren
Bimekizumab
Das subkutan injizierbare Bimekizumab ist ein monoklonaler Antikörper, der selektiv und mit hoher Affinität an die Interleukine IL-17A und IL-17F sowie das daraus entstehende heterodimere Interleukin IL-17A/F bindet und so deren Interaktion mit dem entsprechenden Rezeptorkomplex blockiert.8 Die Substanz wurde in der Schweiz erstmals im Jahr 2022 zugelassen9 und ist indiziert zur Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis (für die Übernahme der Behandlungskosten muss die Limitatio beachtet werden).8
Die Wirksamkeit und Sicherheit von Bimekizumab sowie die Biologie der Keratinozyten und das Psoriasis-Transkriptom im läsionalen Hautgewebe, wurden in einer Phase-IIa-Studie untersucht.10 Im Ergebnis erreichten 79,6% der 49 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis nach 16 Wochen unter Bimekizumab ein PASI-90-Ansprechen.[1],[2] Zusätzlich normalisierten sich die Biologie der Keratinozyten sowie die transkriptionelle Signatur der läsionierten Haut, d. h., der molekulare Status des geschädigten Gewebes verbesserte sich nachhaltig. So wurde nach 8 Wochen die Expression verschiedener Gene von Proteinen der IL-23/IL-17-Achse, darunter IL-17A, IL-17F und IL-23, auf Werte reduziert, wie sie in nicht-läsionalem Hautgewebe vorliegen. Diese tiefgreifende molekulare Reaktion, die bei allen Patienten festgestellt wurde, kann die verlängerte Wirkdauer von Bimekizumab zumindest teilweise erklären.
Bestätigt wurden diese Ergebnisse durch die Daten von BE READY.11 In die multizentrische Phase-III-Studie wurden 435 erwachsene Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis eingeschlossen. Diese erhielten nach Randomisierung im Verhältnis 4:1 Bimekizumab (320 mg alle 4 Wochen; n=349) oder stattdessen Placebo (n=86). Nach 16 Wochen wurden diejenigen Patienten, die Bimekizumab erhalten hatten und ein PASI-90-Ansprechen zeigten, erneut im Verhältnis 1:1:1 randomisiert und bis Woche 56 mit Bimekizumab (320 mg alle 4 Wochen oder alle 8 Wochen) oder Placebo behandelt. Die Auswertung der Daten brachte folgende Ergebnisse:
-
In Woche 16 erreichten unter Bimekizumab 91% der Patienten ein PASI-90-Ansprechen, verglichen mit 1% in der Placebogruppe. Dies entsprach einer signifikanten Risikodifferenz von 89,8 (p<0,0001).
-
Nach 16 Wochen konnte bei 93% der Patienten in der Bimekizumab-Gruppe ein IGA-Score[3] von 0 oder 1 (ohne oder nur mit leichten Hautläsionen) festgestellt werden, gegenüber 1% in der Vergleichsgruppe (Risikodifferenz: 91,5; p<0,0001).
-
Das Ansprechen auf die Therapie mit Bimekizumab (320 mg alle 4 Wochen oder alle 8 Wochen) hielt bis Woche 56 an.
-
Insgesamt wurde Bimekizumab von den Patienten gut vertragen. So kam es unter Bimekizumab bis Woche 16 nur bei 1% der Patienten zu schwerwiegenden therapiebedingten Ereignissen (vs 1% unter Placebo).
Die Patienten zeigten also ein sehr gutes klinisches Ansprechen auf Bimekizumab. Gleichzeitig gab es keine unerwarteten Sicherheitssignale während der Behandlung.
Die Zulassung von Bimekizumab basiert auf den vorgestellten Daten von BE READY sowie auf den Ergebnissen der beiden Phase-III-Studien BE VIVID und BE SURE.8 In BE VIVID erreichten 85% der mit Bimekizumab behandelten Patienten nach 16 Wochen ein PASI-90-Ansprechen und 84% wiesen einen IGA-Score von 0 oder 1 auf.12 In BE SURE lagen die entsprechenden Raten bei 86,2% bzw. 85,3%.13 Die Daten von 989 Patienten aus den Studien BE READY, BE VIVID und BE SURE, die mit Bimekizumab behandelt worden waren, wurden in der Verlängerungsstudie BE BRIGHT gepoolt ausgewertet.14 Die Analyse ergab, dass von den Patienten, die in Woche 16 ein PASI-90-Ansprechen erreicht hatten, dieses Ansprechen am Ende des ersten und dritten Jahres bei 96,5% bzw. 93,0% immer noch nachweisbar war. Auch beim IGA-Score wiesen nach einem und nach drei Jahren noch 94,9% bzw. 92,2% der PASI-90-Responder einen Wert von 0 oder 1 auf. Die Studie zeigte somit, dass Bimekizumab bei einem sehr hohen Anteil der Patienten auch nach langer Therapiedauer noch klinisch wirksam war.
Ixekizumab
Der monoklonale Antikörper wirkt ebenfalls als IL-17A-Inhibitor und wird subkutan appliziert.15 Ixekizumab wurde erstmals im Jahr 2016 in der Schweiz zugelassen16 und ist indiziert zur Behandlung von mittelschwerer bis schwerer Plaque-Psoriasis bei erwachsenen Patienten und bei Kindern ab 6 Jahren und einem Körpergewicht von mindestens 25 kg.15
In die Phase-III-Studie UNCOVER-3 wurden 1346 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis eingeschlossen, die nach Randomisierung im Verhältnis 1:2:2:2 subkutane Injektionen von Placebo, Etanercept (50 mg, zweimal wöchentlich) oder Ixekizumab (80 mg, alle 2 Wochen bzw. alle 4 Wochen nach einer Initialdosis von 160 mg) erhielten.17 In Woche 12 wurden alle Patienten auf Ixekizumab (80 mg, alle 4 Wochen) umgestellt. Nach Woche 60 konnten die Patienten die Dosierung nach Ermessen des Prüfarztes auf 80 mg, alle 2 Wochen erhöhen. Für die Auswertung wurden die Daten derjenigen 385 Teilnehmer berücksichtigt, die Ixekizumab in dem zugelassenen Dosierungsschema erhalten hatten, d. h. anfänglich 160 mg, dann 80 mg alle 2 Wochen und ab der 12. Woche 80 mg alle 4 Wochen, einschliesslich der Patienten, die nach der 60. Woche ihre Dosis wieder erhöht hatten. Bei Anwendung einer modifizierten Non-Responder-Imputation erreichten in Woche 264 von diesen Patienten 78,8% ein PASI-75-Ansprechen, 67,1% ein PASI-90-Ansprechen und 46,2% ein PASI-100-Ansprechen. Wenn die «As-Observed-Methode» angewendet wurde, bei der nur die Daten der Patienten analysiert wurden, die die Visiten abgeschlossen hatten, und bei der keine fehlenden Daten mittels Imputation ergänzt wurden, betrugen die entsprechenden Raten 97,4%, 90,2% und 66,5%. Demnach zeigte Ixekizumab bei Einnahme nach dem zugelassenen Dosierungsschema über 5 Jahre eine anhaltend gute Wirksamkeit. Gleichzeitig entsprach das Sicherheitsprofil den früheren Studien und es gab keine neuen Sicherheitssignale.
Secukinumab
Der subkutan injizierbare, monoklonale Antikörper bindet selektiv an das proinflammatorische Zytokin Interleukin IL-17A und hemmt so dessen Wirkung.18 Secukinumab wurde erstmals im Jahr 2015 in der Schweiz zugelassen19 und ist indiziert zur Behandlung mittelschwerer bis schwerer Plaque-Psoriasis bei erwachsenen und pädiatrischen Patienten ab 6 Jahren.18
Dass Kinder und Jugendliche von einer Behandlung mit Secukinumab profitieren können, zeigen die Daten einer Phase-III-Studie.20 In diese wurden 84 Patienten im Alter von 6 bis <18 Jahren eingeschlossen, die an mittelschwerer bis schwerer Plaque-Psoriasis erkrankt waren. Nach Randomisierung erhielten die Studienteilnehmer subkutanes Secukinumab entweder in niedriger Dosis von 75 bzw. 150 mg, je nach Körpergewicht (LD-Gruppe; n=42), oder stattdessen in hoher Dosis von 75, 150 bzw. 300 mg (HD-Gruppe; n=42). Die Auswertung der Daten von 78 Patienten, die nach 52 Wochen noch in der Studie verbliebenen waren, ergab, dass das PASI-75-Ansprechen in beiden Gruppen ähnlich hoch war (LD-Gruppe: 92,8% vs HD-Gruppe 93,3%). Die PASI-90- und PASI-100-Ansprechraten lagen in der LD-Gruppe bei 78,7% bzw. 53,5% und in der HD-Gruppe bei 84,7% bzw. 70,0%. Die Raten derer, bei denen ein IGA-Score von 0 oder 1 festgestellt wurde, waren in beiden Gruppen ebenfalls vergleichbar hoch (LD-Gruppe: 88,9% vs HD-Gruppe: 84,7%). Das Sicherheitsprofil von Secukinumab entsprach insgesamt dem bei Erwachsenen. Auch nach einem Jahr sprach also noch ein hoher Anteil der pädiatrischen Psoriasis-Patienten auf beide Dosierungsschemata von Secukinumab an, ohne dass es neue Sicherheitssignale für die untersuchten Dosierungen gab.
IL-23-Inhibitoren
Risankizumab
Der monoklonale Antikörper wirkt ebenfalls als IL-23-Inhibitor und wird subkutan injiziert. Risankizumab wurde in der Schweiz erstmals im Jahr 2019 zugelassen21 und ist indiziert zur Behandlung mittelschwerer bis schwerer Plaque-Psoriasis bei erwachsenen Patienten (für die Übernahme der Behandlungskosten muss die Limitatio beachtet werden).
Dass die Patienten mit Psoriasis von einer Therapie mit Risankizumab profitieren können, bestätigen die Ergebnisse der UltIMMa-1 and UltIMMa-2 Studien.
UltIMMa-1 und UltIMMa-2 sind zwei doppelblinde, randomisierte, placebo-kontrollierte und ustekinumab-kontrollierte Phase-3-Studien. Sie wurden an 139 Standorten in verschiedenen Ländern durchgeführt und umfassten Erwachsene mit mäßiger bis schwerer chronischer Plaque-Psoriasis. Diese Studien dauerten 52 Wochen. Die Hauptendpunkte waren der Anteil der Patienten, die eine 90%ige Verbesserung im Psoriasis Area Severity Index (PASI 90) und eine statische Physician’s Global Assessment (sPGA)-Wertung von 0 oder 1 in der 16. Woche erreichten. In diesen Studien zeigte Risankizumab eine überlegene Wirksamkeit im Vergleich zu Placebo und Ustekinumab. Darüber hinaus war die Häufigkeit behandlungsbedingter unerwünschter Ereignisse während der gesamten Studiendauer in allen Behandlungsgruppen ähnlich.22
Die Wirksamkeit und Sicherheit von Risankizumab auch bei hohen Induktionsdosen wird derzeit in der doppelblinden Phase-II-Studie KNOCKOUT untersucht, einschliesslich der anhaltenden Wirksamkeit nach dem Absetzen des Medikaments.23,24 In diese wurden 20 erwachsene Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis eingeschlossen, die nach Randomisierung im Verhältnis 1:1 in den Wochen 0, 4 und 16 jeweils mit 300 mg oder mit 600 mg Risankizumab behandelt wurden, was dem Zwei- bzw. Vierfachen der Standard-Anfangsdosis entsprach. Die Zwischenanalyse der gepoolten Daten beider Patientengruppen nach 28 Wochen ergab, dass 94% ein PASI-90- und 83% ein PASI-100-Ansprechen[4] erreicht hatten.24 In Woche 52 zeigten von den 18 noch in der Studie verbliebenen Patienten 69% ein PASI-90- und 43% PASI-100-Ansprechen.24 Unter Risankizumab waren also auch rund 9 Monate nach der letzten Dosierung noch mehr als 40% der Patienten symptomfrei.
Tildrakizumab
Der subkutan injizierbare IL-23-Inhibitor Tildrakizumab ist in der Schweiz seit dem Jahr 2019 zugelassen.25 Der monoklonale Antikörper ist für die Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis indiziert.26
Dass die Patienten mit Psoriasis auch unter Real-World-Bedingungen von einer Therapie mit Tildrakizumab profitieren können, bestätigen die Ergebnisse einer Open-Label-Studie der Phase IV.27 In diese wurden 55 Erwachsene mit mittelschwerer bis schwerer Plaque-Psoriasis eingeschlossen, die in Woche 0, Woche 4 und danach alle 12 Wochen 100 mg Tildrakizumab erhielten. Die Interimsanalyse nach einer Therapiedauer von 28 Wochen ergab, dass der mittlere PASI-Wert unter Tildrakizumab von 11,6 zu Studienbeginn auf 1,8 reduziert wurde. Das entsprach einer signifikanten Verbesserung um 82,1% (p<0,001). Der mittlere Anteil der betroffenen Körperoberfläche verringerte sich signifikant von 14,5% auf 2,9% und der Schwergrad verbesserte sich gemäss sPGA-Score[5] von 3,2 auf 1,2 (jeweils p<0,001). Gleichzeitig wurde die Behandlung mit Tildrakizumab generell gut vertragen. Darüber hinaus wurden keine neuen Sicherheitssignale beobachtet. Eine neue Zulassung für die Option der Erhöhung auf 200 mg wurde ebenfalls erteilt.
Guselkumab
Der subkutan applizierte IL-23-Inhibitor Guselkumab wurde in der Schweiz im Jahr 2018 erstmals zugelassen.28 Der monoklonale Antikörper ist indiziert zur Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer, chronischer Plaque-Psoriasis (für die Übernahme der Behandlungskosten muss die Limitatio beachtet werden).29,30
Bereits in den Zulassungsstudien VOYAGE 131 und VOYAGE 232 konnte gezeigt werden, dass Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis von einer Behandlung mit Guselkumab durch eine höhere Wirksamkeit im Vergleich zu Adalimumab bei gleichzeitig guter Verträglichkeit profitieren können. Auch in der Phase-III-Studie NAVIGATE33 profitierten die Patienten von Guselkumab, nachdem sie zuvor mit Ustekinumab behandelt worden waren und auf diese Therapie nicht adäquat angesprochen hatten. Die Wirksamkeit und Sicherheit von Guselkumab speziell bei frühzeitiger Intervention wurde unter anderem in der GUIDE-Studie untersucht.34 In die Phase-IIIb-Studie wurden 880 erwachsene Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis eingeschlossen, die eine kurze Krankheitsdauer von ≤2 Jahren (SDD[6], n=357) oder eine lange Krankheitsdauer von >2 Jahren (LDD[7], n=523) aufwiesen. Diese erhielten in den Wochen 0, 4, 12 und 20 jeweils 100 mg Guselkumab. Nach 28 Wochen wiesen 51,8% der Patienten In der SDD-Gruppe einen PASI von 0 auf, zeigten also keine Symptome einer Psoriasis. In der LDD-Gruppe war dies bei 39,4% der Fall (p<0,001). Insgesamt waren 34,4% der Patienten Super-Responder, erreichten also in den Wochen 20 und 28 vollständige Abheilung der Haut. Dabei lag der Prozentsatz in der SDD-Gruppe signifikant höher als in der LDD-Gruppe (43,7% vs 28,1%; p<0,001). Die Daten zeigen, dass Guselkumab bei mittelschwerer bis schwerer Plaque-Psoriasis wirksam ist. Dabei zeigen Patienten mit kürzerer Krankheitsdauer ein noch besseres Ansprechen als Patienten mit längerer Krankheitsdauer. Gleichzeitig wurde Guselkumab von den Patienten gut vertragen, und es gab keine neuen Sicherheitssignale.
Weitere Therapien
Neben Bimekizumab, Guselkumab, Tildrakizumab Risankizumab, Secukinumab und Ixekizumab ist mit dem IL-12/IL-23-Inhibitor Ustekinumab in der Schweiz noch ein weiterer monoklonaler Antikörper zur Therapie der Plaque-Psoriasis zugelassen, der an der IL-23/IL-17-Achse ansetzt.35
Fazit
Mit dem IL-17A/F-Inhibitor und den Inhibitoren der Interleukine IL-17A und IL-23 stehen uns wirksame Optionen für die Therapie der mittelschweren und schweren Plaque-Psoriasis zur Verfügung, die zudem ein günstiges Sicherheitsprofil aufweisen. Dabei setzen die monoklonalen Antikörper an einem für die Pathogenese der Erkrankung entscheidenden Signalweg an und können so die Symptome gezielt bekämpfen.
Interessenskonflikt
Die Autoren erklären, dass das Manuskript ohne jegliche kommerzielle oder finanzielle Unterstützung verfasst wurde, die als potenzielle Interessenkonflikte ausgelegt werden könnten.
Finanzierung
Die Autoren erklären, keine finanzielle Unterstützung von einer Organisation für die eingereichte Arbeit erhalten zu haben.
Autorenbeiträge
Die Autoren haben das Manuskript verfasst und es genehmigt.
PASI: Psoriasis Area and Severity Index
PASI-90-Ansprechen: Verbesserung der psoriatischen Hautläsionen um 90% im Vergleich zum Ausgangswert
IGA: Investigator’s Global Assessment
PASI-90- bzw. PASI-100-Ansprechen: Verbesserung der psoriatischen Hautläsionen um 90% bzw. 100% (vollständiges Abheilen) im Vergleich zum Ausgangswert
sPGA: static Physician Global Assessment
SDD: Short Disease Duration
LDD: Long Disease Duration
_bzw._einem_iga-score_vo.jpg)
_bzw._einem_iga-score_vo.jpg)